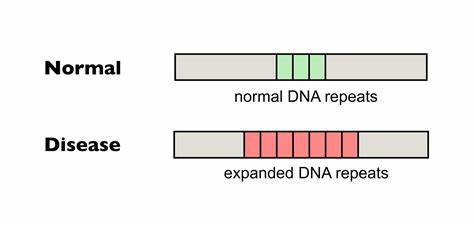
Die Huntington-Krankheit (HD) zählt zu den dominanten, erblichen neurodegenerativen Erkrankungen, welche durch pathologische Erweiterungen von CAG-Trinukleotid-Repeats im HTT-Gen verursacht werden. Diese verlängernden Wiederholungen führen zu einer schrittweisen Veränderung der Hirnfunktion und einem unaufhaltsamen Abbau neuronaler Strukturen, was sich in Bewegungsstörungen, kognitiven Defiziten und psychiatrischen Symptomen manifestiert. Eines der zentralen Probleme bei HD ist die somatische Instabilität der CAG-Repeat-Trakte, also die progressive Ausdehnung der Wiederholungen in Körperzellen, insbesondere im zentralen Nervensystem. Diese somatische Repeat-Expansion trägt maßgeblich zum Fortschreiten und zur Schwere der Krankheit bei. Junge oder kürzlich entwickelte Zellen weisen kürzere Repeat-Längen auf, während ältere Zellen in betroffenen Hirnregionen oft längere und instabilere Repeat-Abschnitte zeigen, welche die neurotoxischen Folgen potenzieren.
Somit stellt die Kontrolle dieser somatischen Expansionen einen vielversprechenden therapeutischen Ansatz dar, um den Krankheitsverlauf zu verlangsamen oder gar zu unterbrechen. Jüngste Fortschritte im präzisen Genom-Editing, insbesondere das Basen-Editing, haben neue Wege eröffnet, um solche Triplet-Repeat-Erweiterungen direkt zu modifizieren. Basen-Editing ermöglicht gezielte, punktgenaue Veränderungen einzelner Nukleotide ohne die Einführung von Doppelstrangbrüchen, was die genomische Integrität bewahrt und unerwünschte Reparaturprozesse minimiert. Im Kontext der Huntington-Krankheit richtet sich das Basen-Editing darauf, die ursprüngliche CAG-Repeats zu „unterbrechen“, indem gezielt die CAG-Codons in CAA-Codons modifiziert werden, ohne die kodierte Glutamin-Aminosäure zu verändern. Solche sogenannten „Synonymen Unterbrechungen“ sind natürlich bei wenigen gesunden Menschen vorhanden und gehen mit einer stabileren Repeat-Länge und milderen Krankheitsverläufen einher.
Die Forschung zeigt, dass durch den Einsatz von cytosinbasierten Baseneditors (CBEs) einerseits und adeninhaltigen Baseneditors (ABEs) andererseits solch gezielte Manipulationen an Pathogenese-relevanten Trinukleotiden möglich sind. Im Speziellen wurden CAG-Repeat-Strecken im HTT-Gen erfolgreich mit CBEs behandelt, wodurch stabile CAA-Unterbrechungen eingeführt wurden. Die Folge ist eine deutliche Reduktion von somatischen Expansionen in patientenabgeleiteten Fibroblasten sowie in HD-Mausmodellen. Die erzielte Effizienz der Editing-Strategien wurde bereits in vitro demonstriert, ehe die Effekte durch AAV9-vermittelte Injektionen in die Hirnventrikel von Neugeborenen-Mäusen nachgewiesen wurden. Dabei zeigte sich eine anhaltende und progressive Erhöhung der umgeschriebenen Repeat-Allele im Gehirn, vorrangig im Cortex und Striatum, die für die Huntington-Pathologie besonders relevant sind.
Dies führte zu einer signifikanten verringerten Somatic Instability, gemessen durch eine verminderte Ausdehnung der CAG-Repeats im Vergleich zu unbehandelten Tieren. Das deutet darauf hin, dass die gezielte Editor-getriebene Unterbrechung des Repeat-Traktes eine funktionelle Bremswirkung auf die krankheitstypischen Prozesse besitzt. Die Bedeutung der somatischen Repeat-Expansion als Schlüsselmechanismus bei HD wird durch weitere Daten untermauert. Einzelzellanalysen von Gehirngeweben von HD-Patienten zeigen, dass eine schleichende Verlängerung der CAG-Tracts über Jahrzehnte vorliegt, bevor kritische Schwellen überschritten werden, an denen schnelle neuronale Degeneration beginnt. Die therapeutische Intervention vor Erreichen dieser Schwellen könnte somit potenziell Prävention oder zumindest Verzögerung der klinischen Manifestation ermöglichen.
Die neue Technologie des Basen-Editings bietet einen bislang einzigartigen, molekular präzisen Weg, um diese Zielmärkte direkt zu beeinflussen. Neben der Modifikation des HTT-Gens selbst wurden in Studien auch andere pathogene Trinukleotid-Repeats adressiert. Das Konzept lässt sich prinzipiell auf weitere Polyglutamin-Erkrankungen oder verwandte Repeat-Expansion-Krankheiten übertragen. Off-Target-Effekte sind zwar stets ein wichtiges Thema bei Genome-Editing-Technologien, doch weisen Untersuchungen mit CAG-spezifischen Baseneditors in Zellkulturen und Tiermodellen überwiegend auf unbedenkliche, meist synonyme oder nicht-kodierende Änderungen hin, die in der Allgemeinbevölkerung naturnah vorkommen. Der weitere Sicherheitsnachweis ist allerdings essentiell für eine klinische Translation.
Das AAV9-System hat sich als geeigneter Vektor für die gezielte Neuronen-Transduktion im Zentralnervensystem erwiesen, insbesondere für die Abgabe von Baseneditor-Komponenten mittels intracerebroventrikulärer Injektion bei Neugeborenen-Mäusen. Dieses Verfahren bewirkt eine stabile und langanhaltende Expression der Editoren und fördert somit eine kontinuierliche Markierung und Stabilisierung der Repeat-Regionen. Die Herausforderung wird künftig in der erfolgreichen Applikation in erwachsenen Tieren und letztlich in Patienten bestehen, einschließlich der zielgenauen Abdeckung aller relevanten Zelltypen und der Minimierung von Immunreaktionen. Die Forschung zu somatischer Repeat-Stabilisierung durch Basen-Editing ergänzt andere therapeutische Ansätze wie RNA-Interferenz, Antisense-Oligonukleotide oder kleine Moleküle, die entweder die Mutanten-Proteinbildung verringern oder die zelluläre DNA-Reparaturmodulation anstreben. Basen-Editing bietet jedoch den Vorteil eines permanenteren genetischen „Fixes“ durch direkte Allelmodifikation.
Damit könnten sich neben symptomatischen Behandlungen erstmals ursächliche Therapien ergeben, die das Fortschreiten auf molekularer Ebene beeinträchtigen. Obwohl momentan Behandlungserfolge auf Zell- und Tiermodellen beruhen, stellt dieser Forschungszweig einen bedeutenden Meilenstein im Kampf gegen Huntington und verwandte TNR-Erkrankungen dar. Er unterstreicht das Potenzial der präzisen Genom-Editierung, genetische Instabilitäten zu korrigieren, die für schwerwiegende neurodegenerative Fehlfunktionen verantwortlich sind. Zusammenfassend lässt sich sagen, dass das Einbringen von synonymer Basenunterbrechung mit zytosinen Baseneditors in CAG-Trinukleotidwiederholungen im HTT-Gen die somatische Expansion der Pathogenitätsträchtigen Repeats deutlich eindämmen kann. Diese molekulare Strategie verringert in Patientenzellen und mehrfachen HD-Mäusexperimenten das Fortschreiten instabiler Repeat-Erweiterungen und eröffnet neue Perspektiven, am Ursprung der Huntington-Krankheit anzusetzen.
Weitere Forschung ist nötig, um die Sicherheit, Effektivität und Applikationstechniken für den Menschen zu optimieren, doch bildet das Basen-Editing einen vielversprechenden Ansatz zur Zukunft der Therapien gegen Trinukleotid-Expansionserkrankungen.