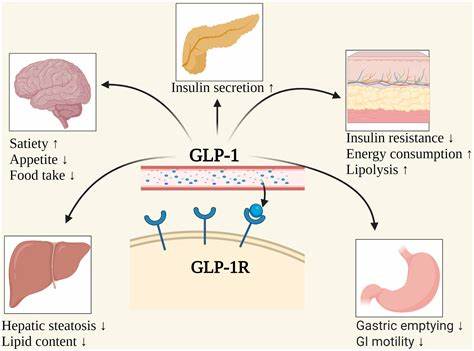
Die Behandlung von Übergewicht und damit verbundenen Erkrankungen wie Typ-2-Diabetes gilt als eine der größten Herausforderungen im Gesundheitswesen. GLP-1 (Glucagon-like Peptid-1) Agonisten haben sich dabei in den letzten Jahren als besonders wirksam erwiesen und sind zu einer festen Größe in der medikamentösen Therapie geworden. Doch es gibt eine faszinierende Beobachtung, die Wissenschaftler vielfach vor ein Rätsel stellte: Sowohl GLP-1-Agonisten als auch Antagonisten des GIP-Rezeptors können zur Gewichtsreduktion beitragen – scheinbar widersprüchlich und überraschend zugleich. Zwei neue wissenschaftliche Studien aus Deutschland und den USA analysieren diese ungewöhnliche Tatsache genauer und liefern interessante Antworten auf die Frage, wie das möglich ist. Beide Forschungsarbeiten, eine vom Team aus München und eine vom amerikanischen Biotechnologieunternehmen Amgen, erschienen gleichzeitig und kommen zu ähnlichen, sich ergänzenden Ergebnissen.
Auf den ersten Blick sollte man annehmen, dass Agonisten und Antagonisten an einem Rezeptor gegensätzliche Effekte auslösen. Genau das passiert aber offensichtlich nicht in dieser Form, besonders wenn es um den GIP-Rezeptor (Glucose-dependent Insulinotropic Polypeptid-Rezeptor) in Kombination mit GLP-1-Rezeptor-Agonisten geht. In Tiermodellen zeigte sich, dass sowohl GIPR-Agonisten als auch GIPR-Antagonisten in Kombination mit GLP-1-Agonisten für eine verbesserte Gewichtsabnahme sorgen. Diese Beobachtung wirkte zunächst kontraintuitiv und ließ vermuten, dass unterschiedliche oder gar parallele Signalwege involviert sein könnten. Die Studien bestätigen, dass die Effekte sowohl von GIPR-Agonisten als auch von -Antagonisten nur dann auftreten, wenn der GIP-Rezeptor selbst vorhanden und funktionstüchtig ist.
Wird der GIPR vollständig genetisch ausgeschaltet, verschwinden die Auswirkungen beider Wirkstoffklassen. Dies schließt Nebenwirkungen auf andere Rezeptoren aus und zeigt ganz klar, dass GIPR der Dreh- und Angelpunkt der Wirkmechanismen ist. Interessanterweise bleiben die Wirkungen der GIPR-Agonisten auch erhalten, wenn der GLP-1-Rezeptor ausgeschaltet ist. Das bedeutet, dass GIPR-Agonisten einen eigenständigen, unabhängigen Wirkweg besitzen. Umgekehrt brauchen GIPR-Antagonisten eine funktionierende GLP-1-Rezeptor-Achse, um ihr Gewicht verlierendes Potential zu entfalten.
Hier wird aus Sicht der Wissenschaft klar, warum sowohl Agonisten als auch Antagonisten an einem Rezeptor scheinbar ähnliches bewirken. Darüber hinaus zeigen die Studien, dass das Zentralnervensystem maßgeblich an diesen Effekten beteiligt ist und sowohl GIPR-Antagonisten als auch GLP-1-Agonisten dort synergistisch agieren können. Amgens Forscher konnten sogar nachweisen, dass die direkte Verabreichung eines GIPR-blockierenden Antikörpers in das Gehirn ausreicht, um die synergistische Gewichtsabnahme in Kombination mit einem GLP-1-Agonisten zu fördern. Noch faszinierender ist, dass genetisches Ausschalten von GIPR ausschließlich im Zentralnervensystem die Wirkung der GLP-1-Agonisten verstärkt. Die Forscher interpretieren dies als Beleg dafür, dass das Zusammenspiel zwischen GIPR- und GLP-1-Rezeptoren im Gehirn eine komplexe Rolle in der Regulierung des Körpergewichts spielt.
Das Münchner Team ergänzt diese Erkenntnisse um die Rolle des peripheren Nervensystems. Dort konnte gezeigt werden, dass der Ausschluss von GIPR außerhalb des Gehirns, also im peripheren Nervensystem, keinen Einfluss auf die schrumpfende Wirkung von GIPR-Antagonisten in Kombination mit GLP-1-Agonisten auf das Körpergewicht hat. Allerdings verlieren die Tiere in diesem Modell ihre Resistenz gegenüber Problemen des Glukosestoffwechsels, wenn sie einer zuckerreichen Ernährung ausgesetzt sind. Somit wird deutlich, dass der periphere GIP-Rezeptor eine wichtige Rolle bei der Regulation der Glukosehomöostase übernimmt, aber nicht beim Körpergewicht. Das unterstreicht, wie differenziert die verschiedenen Signalwege untereinander verwoben sind.
Diese neu gewonnenen Erkenntnisse haben weitreichende Konsequenzen für die pharmakologische Entwicklung. Unter anderem eröffnen sie die Möglichkeit, gezielter Medikamente zu entwickeln, die bestimmte Signalwege stimulieren oder hemmen, um die Gewichtsabnahme maximal zu unterstützen ohne dabei mehr Nebenwirkungen zu riskieren. Auch die Wechselwirkungen zwischen GIPR und GLP-1 eines Tages besser zu verstehen, könnte bedeuten, dass Therapien individualisierter und effektiver gestaltet werden können. Über die eigentlichen Wirkungen auf Körpergewicht und Glukose metabolism hinaus sind auch mögliche Auswirkungen auf andere Verhaltensaspekte von Interesse. Bisherige Studien legen nahe, dass GLP-1-Agonisten auch Einfluss auf nicht-essensbezogene Verhaltensweisen wie Alkohol- oder andere Süchte haben können.
Wie dabei GIPR-Agonisten oder -Antagonisten interagieren und ob sie die Wirkung verstärken oder abschwächen, ist ein vielversprechendes Forschungsfeld mit enormem therapeutischem Potenzial. Insgesamt verdeutlichen die beiden Studien eine wesentliche Tatsache: Die Wirkmechanismen von GLP-1- und GIP-Rezeptorsystemen sind komplex, teils noch ungelöst und zum Teil sogar paradox erscheinend. Dennoch gelingt es der Wissenschaft immer besser, die Signalwege zu entwirren – was Optimismus für neue, wirkungsvollere Behandlungsansätze bei Übergewicht, Diabetes und anderen metabolischen Erkrankungen weckt. Eine verstärkte Zusammenarbeit zwischen Forschungsteams weltweit und weitere Untersuchungen werden in den kommenden Jahren wichtige Details offenbaren und sicher noch für einige Überraschungen sorgen. Für Patienten bedeuten diese Fortschritte Hoffnung auf Therapien, die leichter verträglich sind und noch besser helfen, das Körpergewicht nachhaltig zu reduzieren und Stoffwechselstörungen in den Griff zu bekommen.
Für Fachkreise sind die Erkenntnisse eine Aufforderung, Modelle der Rezeptorfunktion zu überdenken und Präparate weiterzuentwickeln, die das Zusammenspiel von GLP-1- und GIP-Rezeptoren ausnutzen. Die Zukunft der medikamentösen Behandlung von Adipositas und Diabetes sieht also spannend aus, mit vielversprechenden Ansätzen, die sowohl auf Basis von GLP-1- als auch GIP-Rezeptor-Modulation beruhen. Die Fortschritte verdeutlichen, dass in der biologischen Komplexität der Signalwege Chancen stecken, die wir erst noch vollständig zu verstehen und zu nutzen lernen müssen.