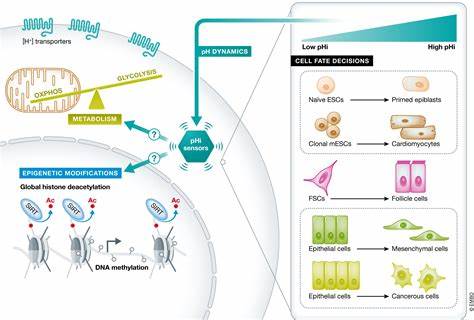
Die Regeneration von Geweben ist ein komplexer Prozess, bei dem Zellen nicht nur proliferieren, sondern auch spezialisierte Funktionen übernehmen müssen. Lange Zeit wurde angenommen, dass vor allem die Steuerung von Genen und Transkriptionsfaktoren die Zellschicksale während der Geweberegeneration bestimmen. Neueste Forschungsergebnisse zeigen jedoch, dass metabolische Anpassungen eine ebenso zentrale Rolle spielen und aktiv die Differenzierung und Funktion von Zellen beeinflussen können. Das intestinale Epithel dient als herausragendes Modell für die Untersuchung dieser Zusammenhänge. Es besteht aus einer vielzelligen Struktur, in der intestinalen Stammzellen (ISCs) in den Krypten des Darms kontinuierlich neue Tochterzellen hervorbringen, die sich entweder zur absorptiven oder zur sekretorischen Zelllinie differenzieren.
Diese Differenzierungswege sind essenziell, um die Vielzahl von Funktionen des Darms zu gewährleisten, darunter Nährstoffaufnahme, Schleimproduktion und Immunabwehr. Eine zentrale Entdeckung im Bereich der metabolischen Regulierung von Zellschicksalen ist die unterschiedliche Aktivität der Enzyme des Tricarbonsäurezyklus (TCA-Zyklus) in den verschiedenen Darmzelllinien. Entgegen der Vorstellung, dass diese Enzyme in allen Zellen einheitlich exprimiert werden, besteht eine ausgeprägte Heterogenität: Während die absorptiven Zellvorläufer eine verstärkte Expression von TCA-Zyklus-Enzymen aufweisen, insbesondere der α-Ketoglutarat-Dehydrogenase (OGDH)-Komplex, zeigen sekretorische Vorläufer eine reduzierte Expression dieser Enzyme. Dieser Enzymunterschied ist nicht nur ein epiphänomenaler Marker, sondern hat funktionelle Konsequenzen. Die erhöhte OGDH-Aktivität in der absorptiven Linie bedient die hohen bioenergetischen und biosynthetischen Bedürfnisse der Enterozyten, die schnell expandieren und für die effektive Nährstoffaufnahme verantwortlich sind.
Im Gegensatz dazu unterstützt die reduzierte OGDH-Aktivität in sekretorischen Zellen erhöhte α-Ketoglutarat-Level, die wiederum eine epigenetische Steuerung der Differenzierung über α-Ketoglutarat-abhängige Dioxygenasen ermöglichen. Diese Dioxygenasen sind Enzyme, die DNA- und Histonmodifikationen katalysieren und dadurch die Genexpression verändern. Besonders wichtig ist hierbei die Umwandlung von 5-Methylcytosin zu 5-Hydroxymethylcytosin, ein Prozess, der als Demethylierung gewertet wird und für die Aktivierung differenzierungsspezifischer Gene nötig ist. In sekretorischen Darmzellen konnte ein erhöhter Gehalt an 5-Hydroxymethylcytosin beobachtet werden, der mit steigenden α-Ketoglutarat-Spiegeln korreliert. Durch Experimente mit α-Ketoglutarat-Analoga konnte gezeigt werden, dass eine Erhöhung von α-Ketoglutarat die Differenzierung in die sekretorische Linie fördert, während die Inhibition dieser Dioxygenasen diesen Prozess hemmt.
Interessanterweise regulieren spezifische Transkriptionsfaktoren wie HNF4 die Expression von OGDH in der absorptiven Linie. HNF4 ist für die Etablierung und Aufrechterhaltung der Enterozyten-Identität unverzichtbar und aktiviert direkt das Ogdh-Gen. Dieses Zusammenspiel zeigt, wie Transkriptionsfaktoren und Stoffwechselwege eng verzahnt sind, um eine koordinierte Differenzierung sicherzustellen. Auf funktionaler Ebene ist die Abhängigkeit von OGDH in den verschiedenen Zelllinien unterschiedlich. Eine Suppression von OGDH führt im absorptiven Kompartiment zu schweren metabolischen Defiziten, verursacht Energieengpässe und induziert Zelltod.
Dagegen fördert eine OGDH-Hemmung in den intestinalen Stammzellen den Übergang in die sekretorische Differenzierung ohne Zelltod. Diese Erkenntnisse haben wichtige therapeutische Konsequenzen, insbesondere im Kontext von entzündlichen Darmerkrankungen wie Morbus Crohn oder Colitis ulcerosa. Patienten mit solchen Erkrankungen zeigen häufig eine gestörte Balance zwischen den Zelllinien, mit einem Mangel an sekretorischen Zellen, die für die Immunabwehr und Barrierefunktion des Darms grundlegend sind. In entsprechenden Tiermodellen wurde beobachtet, dass während der akuten Entzündung α-Ketoglutarat-Spiegel sinken, während OGDH-Expression steigt, was die sekretorische Differenzierung hemmt und die Reparaturfähigkeit des Gewebes beeinträchtigt. Die therapeutische Substitution von α-Ketoglutarat oder gezielte teilweise Inhibition von OGDH konnte in Versuchen bei Mäusen die Wiederherstellung der sekretorischen Zellpopulationen fördern und die Geweberegeneration verbessern.
Insbesondere in Modellen der durch Dextran-Sulfat-Natrium (DSS) induzierten Colitis führte die Verabreichung von α-Ketoglutarat zu einer erhöhten Anzahl funktionsfähiger sekretorischer Zellen, verbesserter Darmarchitektur und verringerter Entzündung. Auch in einem immunvermittelten Colitismodell zeigte sich eine vergleichbare Wirkung. Darüber hinaus besitzen sekretorische Zellen eine bemerkenswerte Plastizität, da sie unter bestimmten Bedingungen, wie bei Gewebeschäden, zurück zu intestinalen Stammzellen dedifferenzieren können, um das Stammzellkompartiment aufzufüllen. Die Steigerung der Differenzierung in die sekretorische Linie durch α-Ketoglutarat könnte somit die Regenerationskapazität des Gewebes über diesen Mechanismus zusätzlich unterstützen. Diese Erkenntnisse führen zu einem Paradigmenwechsel: Nicht nur genetische und epigenetische Signale, sondern auch zentrale metabolische Wege und deren intermediäre Metaboliten sind maßgeblich an Zellschicksalsentscheidungen während der Geweberegeneration beteiligt.
Das Zusammenspiel zwischen Transkriptionsfaktoren wie HNF4 und Stoffwechselregulation durch Enzyme wie OGDH bildet eine Signalbrücke zwischen Zellidentität und Energieversorgung. Die dynamische Regulation des TCA-Zyklus in verschiedenen Darmzelllinien verdeutlicht, dass Stoffwechselwege keine starren Hausmeisterfunktionen erfüllen, sondern flexibel an die Bedürfnisse verschiedener Zelltypen angepasst werden. Absorptive Zellen benötigen eine effiziente ATP-Produktion über oxidative Phosphorylierung, während sekretorische Zellen ihre Differenzierung durch metabolische Modulation der Epigenetik fördern. Diese molekularen Mechanismen eröffnen neue therapeutische Möglichkeiten zur Behandlung von Erkrankungen, die mit gestörter Geweberegeneration und Differenzierungsabweichungen einhergehen. Die gezielte Modulation von OGDH-Aktivität oder α-Ketoglutarat-Spiegeln könnte die Reparatur entzündeter oder geschädigter Darmepithelien verbessern und das Gleichgewicht der Zelltypen wiederherstellen.
Zukünftige Untersuchungen konzentrieren sich darauf, die genauen Effektorwege und Zielproteine der α-Ketoglutarat-abhängigen Dioxygenasen besser zu verstehen und auch in anderen Gewebearten vergleichbare Wirksamkeiten zu prüfen. Zudem besteht ein Interesse daran, metabolische Interventionen mit anderen Formen der regenerativen Medizin zu kombinieren, um multifaktorielle Therapiestrategien zu entwickeln. Zusammenfassend zeigen aktuelle Studien einen tiefgreifenden Einfluss des Stoffwechsels auf Zellschicksale bei der Regeneration. Die gezielte Beeinflussung metabolischer Wege stellt einen vielversprechenden Ansatz dar, um regenerative Prozesse im Darm zu steuern, entzündliche Erkrankungen effektiv zu behandeln und die Gewebefunktion langfristig zu erhalten.