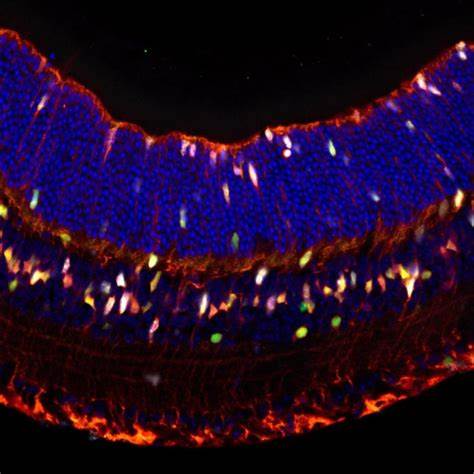
Die Fähigkeit des menschlichen Körpers, beschädigte Sinneszellen zu regenerieren, ist äußerst begrenzt. Besonders betroffen davon sind Zellen im Auge und im Innenohr, die für Seh- und Hörvermögen verantwortlich sind. Ein Verlust dieser sensorischen Funktionen wirkt sich dramatisch auf die Lebensqualität aus und stellt bislang eine große Herausforderung für die Medizin dar. Neueste wissenschaftliche Forschungen aus dem Keck School of Medicine der University of Southern California (USC) eröffnen nun neue Perspektiven: Durch das gezielte Ausschalten eines genetischen Signals kann die Regeneration von Seh- und Hörzellen in Mäusen wieder ausgelöst werden, was möglicherweise den Grundstein für zukünftige Therapien bei Menschen legt. Forscherinnen und Forscher konnten identifizieren, wie eine bestimmte Genaktivität bei Säugetieren die natürliche Zellvermehrung blockiert und mit welchen Mitteln sich dieser Prozess umgehen lässt.
Dieses Wissen könnte in naher Zukunft dazu führen, dass Menschen, die unter altersbedingtem Sehverlust oder Hörschäden leiden, wieder von einer Verbesserung ihrer Sinnesleistung profitieren können. Im Zentrum der Studie steht ein Signalweg, der als Hippo-Signalweg bekannt ist. Diese Gruppe von Genen reguliert das Zellwachstum, indem sie eine Art Stoppsignal an Zellen sendet. Bei Verletzungen oder Zellschäden ist eine kontrollierte Zellteilung entscheidend, um verlorene oder beschädigte Zellen zu ersetzen. Bei Säugetieren funktioniert diese Regeneration jedoch in Auge und Ohr nur eingeschränkt, da der Hippo-Signalweg genau dieses Zellwachstum blockiert.
Der Ansatz der Forscher war, die Funktion dieser Hemmsignale zu untersuchen und sie gezielt molekular zu hemmen, um die natürliche Regenerationsfähigkeit wieder zu ermöglichen. Sie entwickelten einen Hemmstoff, der die Wirkung der Schlüsselproteine Lats1 und Lats2 im Hippo-Signalweg blockiert, was die Zellteilung in bestimmten Bereichen des Innenohrs anregte. Dabei konnten die Wissenschaftler beobachten, dass sich die sogenannten Stützzellen – Vorläuferzellen, die sich zu sensorischen Zellen entwickeln können – im Gleichgewichtsorgan namens Utrikulus aktiv vermehrten. Interessanterweise gab es im sogenannten Corti-Organ des Innenohrs, welches die Hörfunktion steuert, anfangs keine Zellvermehrung durch diese Behandlung. Eine genauere Analyse zeigte, dass hier das Protein p27Kip1 eine entscheidende Rolle spielt.
Dieses Protein wirkt als weiterer Blockierer der Zellteilung und verhindert so die Regeneration von Hörzellen. Indem die Forscher die Aktivität dieses Proteins in genetisch veränderten Mäusen reduzierten, konnten sie sowohl im Corti-Organ als auch in der Netzhaut des Auges eine Vermehrung der Progenitorzellen auslösen. Besonders spannend ist, dass im Auge die sogenannten Müller-Gliazellen, die ebenfalls Vorläuferfunktion besitzen, nicht nur proliferierten, sondern einige ihrer Nachkommen sich in sensorische Photorezeptoren und andere neuronale Zelltypen verwandelten, ohne dass weitere Eingriffe nötig waren. Diese Erkenntnis zeigt eine natürliche Regenerationsfähigkeit auf, die bei Säugetieren bisher als nicht existent galt. Die Konsequenzen dieser Entdeckung sind weitreichend: Ein gezieltes pharmakologisches Vorgehen, das diese Hemmmechanismen ausschaltet oder abschwächt, könnte in Zukunft zur Basis von Therapien werden, die sensorische Funktionen wiederherstellen.
Dabei könnte der Zeitraum nach einer Verletzung oder einem Zellverlust besonders günstig sein, wenn das p27Kip1-Protein von Natur aus kurzzeitig abnimmt. In diesem therapeutischen Fenster bietet sich die Gelegenheit, die Regeneration durch medikamentöse Hemmung des Hippo-Signalwegs zu fördern. Die Studie unter Leitung von Dr. Ksenia Gnedeva liefert dabei nicht nur neue wissenschaftliche Einblicke, sondern auch potenzielle neue Zielstrukturen für die Entwicklung von Medikamenten gegen altersbedingten oder verletzungsbedingten Sehverlust und Hörminderung. Die Förderung der Proliferation von Progenitorzellen und deren Differenzierung zu funktionalen Sinneszellen könnte die Grundlage einer zukünftigen regenerativen Medizin bilden, die auf molekularer Ebene agiert.
Darüber hinaus wurde die Forschung vom NIH gefördert, was die Bedeutung und Relevanz unterstreicht. Besondere Beachtung verdient auch die Tatsache, dass Dr. Gnedeva an mehreren Patentanmeldungen beteiligt ist, die auf der Grundlage dieser Forschung neue Behandlungsmethoden vorantreiben sollen. Dabei handelt es sich um Inhibitoren des Lats-Kinase-Proteins sowie spezielle chemische Verbindungen, die auf die zelluläre Proliferation und Verbesserung des Hörvermögens abzielen. Diese patentierten Technologien könnten zukünftig in der pharmazeutischen Industrie als Grundlage für innovative Therapien genutzt werden.
Die Entdeckung, dass der Hippo-Signalweg und das p27Kip1-Protein gemeinsam die Zellregeneration verhindern, erklärt, warum Säugetiere im Gegensatz zu anderen Tieren wie Fischen oder Fröschen kaum natürliche Wiederherstellung im Auge und Ohr zeigen. Während sich beispielsweise Fische ihre Sinneszellen im Inneren des Ohres und der Netzhaut nach Verletzungen regenerieren können, sind Säugetiere stark limitiert, was die Entwicklung von Hör- und Sehfunktionen betrifft. Die neue Studie öffnet somit ein Fenster zu einem biologischen Mechanismus, der bisher unbekannt war oder nicht in diesem Zusammenhang erkannt wurde. Die Herausforderung für die Wissenschaft wird es nun sein, diese Erkenntnisse in klinische Anwendungen zu überführen. Die Sicherheit und Effektivität von Hippo-Signalweg-Hemmstoffen müssen in weiteren Studien bei höheren Tiermodellen und schließlich im Menschen getestet werden.
Gleichzeitig gilt es, mögliche Nebenwirkungen zu minimieren, da dieser Signalweg auch in anderen Geweben Zellwachstum reguliert und daher ein Risiko für unerwünschte Zellproliferation besteht. Langfristig könnte diese Forschung jedoch das Potential in sich bergen, Millionen von Menschen mit Seh- und Hörverlust neue Lebensqualität zu bieten. Erkrankungen wie altersbedingte Makuladegeneration oder Hörverlust durch Lärm- und Altersschäden könnten zukünftig mit Medikamenten behandelt werden, die gezielt die natürliche Regenerationsfähigkeit des Körpers wieder aktivieren. Somit markiert der genetische „Schalter“ im Hippo-Signalweg einen entscheidenden Meilenstein in der regenerativen Biologie und Medizin. Die Kombination aus molekularbiologischer Grundlagenforschung und angewandter Pharmakologie zeigt exemplarisch, wie komplexe biologische Barrieren durch innovative Ansätze überwunden werden können.
USC-Forscher und ihre internationalen Kollegen arbeiten bereits daran, spezifischere und effektivere Hemmstoffe zu entwickeln, die in Zukunft möglicherweise in Form von Augentropfen oder Ohrinjektionen verabreicht werden können. Die Aussicht, nicht-invasiv defekte Sinneszellen zu erneuern, revolutioniert die Behandlungsaussichten im Bereich von Neurologie und Sinnesorganmedizin. Darüber hinaus öffnet die Forschung auch Fragen nach der Rolle von genetischen Faktoren in der individuellen Regenerationsfähigkeit und wie diese möglicherweise durch personalisierte Medizin gezielt beeinflusst werden können. Erste Erkenntnisse legen nahe, dass ein Zusammenspiel verschiedener Signalwege, einschließlich Hippo und p27Kip1, über die Reparaturprozesse entscheidet. Dieses Wissen ermöglicht eine präzisere Anpassung zukünftiger Therapien.
Insgesamt steht die regenerative Medizin durch die Erkenntnisse zu Gen-Switches, welche Seh- und Hörfunktionen steuern, vor einem bedeutenden Durchbruch. Während die praktische Umsetzung noch einige Zeit in Anspruch nehmen wird, bieten die aktuellen Forschungsresultate Hoffnung für Betroffene und neue Impulse für die wissenschaftliche Gemeinschaft rund um die Themen Hör- und Sehschäden. Das Verständnis der molekularen Mechanismen, die die Zellregeneration kontrollieren, stellt hierbei eine Schlüsselkomponente dar, um innovative Behandlungsstrategien zu entwickeln, die dauerhaften Sensorverlust wirksam entgegenwirken können.