Krebs ist eine der komplexesten und herausforderndsten Erkrankungen unserer Zeit, die weltweit zahlreiche Menschen betrifft. Die Suche nach effektiven Behandlungsansätzen steht dabei im Vordergrund der medizinischen Forschung. Ein neuer und vielversprechender Ansatz fokussiert sich auf den Stoffwechsel der Tumorzellen und deren Abhängigkeit von bestimmten Nährstoffen wie Glukose und Fettsäuren. Hier setzt die innovative Methode der Implantation gentechnisch hergestellter Adipozyten (Fettzellen) an, um das Tumorwachstum durch gezielte Konkurrenz um Nährstoffe zu hemmen. Diese Technologie schafft einen neuartigen therapeutischen Weg, der das Potenzial hat, die Onkologie nachhaltig zu verändern.
Tumoren zeichnen sich durch ihren hohen Bedarf an Energie und Nährstoffen aus, um ihr unkontrolliertes Wachstum und ihre Proliferation aufrechtzuerhalten. Besonders auffällig ist die sogenannte „Warburg-Effekt“, bei dem Tumorzellen selbst in Gegenwart von Sauerstoff bevorzugt Glukose durch aerobe Glykolyse abbauen, um Energie und Bausteine für weiteres Wachstum zu gewinnen. Darüber hinaus sind viele Krebsarten stark auf Fettsäuren angewiesen, da diese doppelt so viel Energie liefern wie Glukose und unter hypoxischen Bedingungen eine wichtige Rolle spielen. Somit nutzt der Tumormikromilieu die vorhandenen Ressourcen extrem effizient und konkurriert mit normalen Zellen um lebenswichtige Substrate. Die Idee, diesen Nährstoffwettbewerb im Tumormikromilieu gezielt zu beeinflussen, führte zur Entwicklung der sogenannten adiposen Manipulations-Transplantation (AMT).
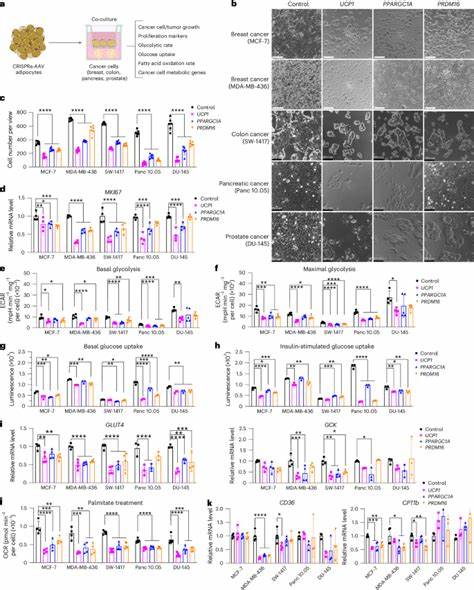
Hierbei werden menschliche weiße Adipozyten mittels CRISPR-basierter Genaktivierung so umprogrammiert, dass sie verstärkt Energie durch Glukose- und Fettsäureverbrauch aufnehmen und verwerten. Insbesondere die Steigerung des Expression des Gens für das Uncoupling Protein 1 (UCP1) lässt die Fettzellen einen „braunen“ Fettzell-ähnlichen Zustand einnehmen. In diesem Zustand sind die Adipozyten metabolisch hochaktiv und konkurrieren erfolgreich um die Nährstoffe mit den Tumorzellen, wodurch diesen die Mittel für ihr Wachstum entzogen werden. Technologisch basiert die AMT auf der Verwendung von CRISPRa (CRISPR-aktivator), einer Technologie zur präzisen und gesteuerten Hochregulierung spezifischer Gene. Zielgene sind vor allem UCP1, aber auch andere Regulatoren wie PPARGC1A und PRDM16, die beim Prozess des „Braunwerdens“ von weißen Fettzellen eine Schlüsselrolle spielen.
Die modifizierten Adipozyten werden zunächst ex vivo – also außerhalb des Körpers – gentechnisch bearbeitet und dann als sogenannte Adipose Organoide, dreidimensionale Gewebemodelle, neben oder sogar in der Nähe von Tumoren implantiert. Vielseitige Krebsarten wie Brust-, Bauchspeicheldrüsen-, Kolon- und Prostatakrebs wurden in präklinischen Modellen untersucht. Die Ergebnisse sind vielversprechend: In vitro zeigten die mit UCP1 aktivierten Adipozyten eine starke Hemmung der Krebszellproliferation durch die Reduktion der Glykolyse und der Fettsäureoxidation. Diese Effekte führten in Tiermodellen zu signifikant verkleinerten Tumoren, reduziertem Sauerstoffmangel innerhalb des Tumors (Hypoxie), verringerter Gefäßbildung und gesteigerter Apoptose in den Tumorzellen. Eine faszinierende Entdeckung ist die Fähigkeit, die modifizierten Fettzell-Organoide nicht nur in unmittelbarer Tumornähe, sondern auch an entfernten Stellen zu implantieren und dennoch eine systematische Suppression der Tumorprogression zu erreichen.
Dies unterstützt die Hypothese, dass metabolische Ressourcen im gesamten Organismus umkämpft werden und dass eine gezielte Erhöhung des Energieverbrauchs durch braune Adipozyten die systemische Glukose- und Fettsäureverfügbarkeit einschränkt – ein Effekt, der sich auch in reduzierten Insulinspiegeln manifestiert, was wiederum die Tumorwachstumsrate beeinflussen kann. Ebenfalls wurde eine induzierbare Version des Systems mit Tetracyclin-Steuerung entwickelt, die eine präzise Kontrolle und Anpassung der Genaktivierung in den Implantaten ermöglicht. Alternativ kann die Verabreichung der Adiopsoen-Organoide mittels eines biokompatiblen Polymer-Scaffolds erfolgen, was eine sichere Verankerung, Funktionserhaltung der Zellen und spätere Entfernung oder Austausch erlaubt. Diese Aspekte sind für eine klinische Translation von besonderer Bedeutung, um die Therapie an individuelle Patientenbedürfnisse anpassen zu können und eventuelle Nebenwirkungen zu minimieren. Darüber hinaus bietet das System auch eine umfangreiche Anpassungsfähigkeit.
So konnte durch Hochregulierung des Enzyms Uridine Phosphorylase 1 (UPP1) in Adipozyten ein gezielter Angriff auf uridinabhängige Stoffwechselwege bei Bauchspeicheldrüsenadenokarzinomen gezeigt werden, was die Tumorprogression ebenfalls deutlich hemmte. Die AMT-Technologie lässt sich somit an verschiedene Tumormetabolismen anpassen, was die breite Anwendbarkeit und das Potenzial als vielseitige onkologische Therapie unterstreicht. Ein weiterer wichtiger Schritt in Richtung klinischer Anwendung wurde durch die Behandlung von Adipozyten gewonnen, die direkt aus menschlichem Brustgewebe isoliert wurden. Diese gewebebasierten Zellen konnten erfolgreich im Labor gentechnisch modifiziert und in Ko-Kulturen mit Patienten-bezogenen Krebsorganoiden eingesetzt werden. Die Hemmung von Krebswachstum und Proliferation bestätigte die Wirksamkeit am Modell menschlicher Tumorerkrankung und stellt die Möglichkeit einer personalisierten Therapieoption dar.
Das mechanistische Prinzip hinter AMT ist im Wesentlichen die metabolische Konkurrenz. Indem die modifizierten Adipozyten mehr Energie und Substrate verbrauchen als die Tumorzellen, entziehen sie den Krebszellen wichtige Ressourcen, was zu deren Wachstumshemmung und erhöhtem Zelltod führt. Gleichzeitig werden im Körper systemische Effekte erzielt, wie verbesserte Glukosetoleranz und erhöhte Insulinsensitivität, die den Tumor weiter beeinträchtigen. Diese duale Wirkung – lokale Nährstoffkonkurrenz und Steuerung des gesamten Stoffwechsels – macht das Verfahren besonders effektiv. Der Ansatz der adiposen Manipulations-Transplantation profitiert zudem von der klinisch sehr gut etablierten Praxis der Liposuktion und Fetttransplantation.
Adipozyten können relativ einfach gewonnen, modifiziert und reimplantiert werden. In der plastischen und rekonstruktiven Chirurgie werden solche Verfahren bereits routinemäßig eingesetzt, was die Integration der AMT in bestehende Behandlungspfade erleichtert. Die 3D-Adipose-Organoide wiederum stellen eine fortschrittliche Zellkulturform dar, die die funktionelle Heterogenität und Interaktionen des Gewebes besser abbildet als isolierte Zellen. Neben den fruchtbaren Möglichkeiten bietet die AMT-Technologie auch methodische Flexibilität durch verschiedene Gentechnologien oder pharmakologische Ansätze, mit denen die adipösen Zellen entsprechend ihres Metabolismus zu optimieren sind. Verschiedene Vektoren, Genregulationssysteme oder sogar gezielte Geneditierungen können eingesetzt werden, um spezifische Bedürfnisse von Patienten oder Tumortypen zu erfüllen.
Natürlich stellen sich noch Herausforderungen. Die Sorge vor möglichen Nebenwirkungen wie der begleitenden Kachexie – einem Verlust von Muskeln und Fettgewebe in der Spätphase von Krebserkrankungen – muss adressiert werden. Auch die langfristige Stabilität, Sicherheit und die kontrollierte Einschaltung der genetischen Modifikationen sind wichtige Themen für weiterführende Forschung und klinische Studien. Die Möglichkeit einer reversiblen Regulation mittels Medikamenten oder der Entfernung der Zell-Implantate durch spezielle Scaffold-Systeme bietet hier Lösungsansätze. Zusammenfassend lässt sich sagen, dass der Ansatz der Implantation gentechnisch veränderter Adipozyten in der Krebstherapie ein innovatives und wirkungsvolles Konzept darstellt.
Durch das geschickte Ausnutzen der metabolischen Bedürfnisse von Tumoren und ihrer Konkurrenzfähigkeit gegenüber flexibel aktivierten Fettzellen bietet sich eine neuartige Behandlungsstrategie, die verschiedene Krebsarten adressieren kann. Die ex vivo Modifikation von Fettgewebe in Kombination mit personalisierten Organotyp-Modellen sowie der Einsatz kontrollierbarer Genaktivatoren eröffnet Chancen für die individualisierte Krebsbehandlung im klinischen Alltag. Mit weiteren Fortschritten in der Technik und in der klinischen Erprobung könnte diese Methode in absehbarer Zeit zu einem wichtigen Baustein der Onkologie werden und Betroffenen neue Hoffnung bieten.