Die Behandlung von Krebs stellt die Medizin weiterhin vor enorme Herausforderungen. Trotz zahlreicher Fortschritte in Chirurgie, Chemotherapie und zielgerichteten Therapien suchen Forscher stetig nach neuen Wegen, um das unkontrollierte Wachstum von Tumoren besser zu bekämpfen. Eine aktuell vielversprechende Entwicklung ist der Einsatz von ingenieurtechnisch bearbeiteten Adipozyten – also genetisch modifizierten Fettzellen –, die gezielt in den Tumormikromilieu eingebracht werden, um das Fortschreiten von Krebs effektiv zu hemmen. Diese neuartige Strategie, die als adipose manipulation transplantation (AMT) bezeichnet wird, nutzt die Fähigkeit von spezialisierten Fettzellen, Nährstoffe von Krebszellen zu „kapern“ und sie so auszuhungern, was das Tumorwachstum stark reduziert. Das Konzept beruht auf der Geschichte, dass Tumore einen sehr hohen Bedarf an Energiequellen wie Glukose und Fettsäuren haben, um ungebremst zu wachsen und zu metastasieren.
Dabei greifen Krebszellen metabolische Strategien auf, welche die klassische Stoffwechselphysiologie verändern. Insbesondere ist die sogenannte „Warburg-Effekt“ bekannt, bei dem Tumorzellen selbst in Gegenwart von Sauerstoff bevorzugt Glukose über die Glykolyse, also den anaeroben Stoffwechsel, verarbeiten. Ebenso nutzen sie Lipide intensiv, und können ihre Eigenschaften an das hypoxische, nährstoffarme Milieu anpassen. Ansätze, die den Stoffwechsel von Krebszellen angreifen, gelten daher als zukunftsweisend, aber die Umsetzung in klinische Therapien ist komplex und mit Nebenwirkungen versehen. Im Rahmen der AMT-Strategie wird das Potential von weißen Adipozyten, die sich zu braun-ähnlichen oder beigeartigen Fetten umprogrammieren lassen, genutzt.
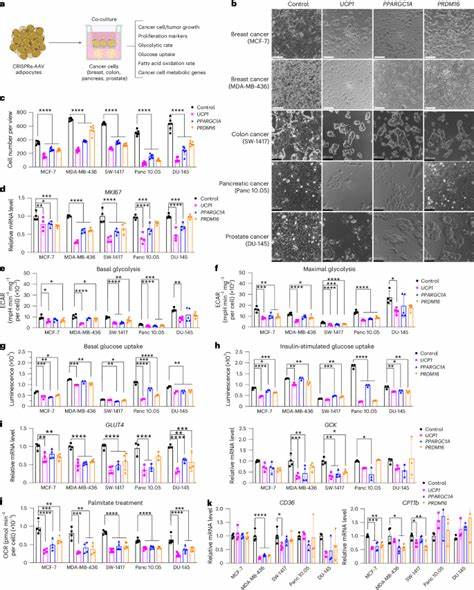
Braunes Fettgewebe zeichnet sich insbesondere durch die Expression des sogenannten uncoupling protein 1 (UCP1) aus. UCP1 ermöglicht eine hohe Stoffwechselaktivität, da es die Energienutzung in Form von Wärme freisetzt, also thermogenetisch wirkt. Typischerweise wird braunes Fettgewebe bei Kälte aktiviert und zieht entsprechenden erhöhten Energieverbrauch nach sich. Studien haben gezeigt, dass durch Aktivierung von braunem Fett das Tumorwachstum gehemmt werden kann; leider ist das „kalte Anheizen“ im Patienten alltagsuntauglich und unbequem. Um dieses Problem zu umgehen, entwickelten Wissenschaftler eine Methode, bei der mittels CRISPR-Aktivator-Technologie gezielt Gene wie UCP1, PPARGC1A oder PRDM16 in weißen Adipozyten hochreguliert werden.
Diese genetisch programmierten Fettzellen zeigen charakteristische Merkmale des braunen Fettgewebes und können dadurch wesentlich mehr Glukose und Fettsäuren aufnehmen und verstoffwechseln. Werden diese modifizierten Zellen als kleine Organoide oder Zellklumpen zusammen mit Tumorzellen implantiert, so konkurrieren sie metabolisch mit den Tumoren um die Energiequellen. Das Ergebnis ist eine deutliche Verlangsamung des Tumorwachstums. Diese Wirkung wurde sowohl in vitro (also Zellkulturen) als auch in verschiedenen präklinischen Tiermodellen – einschließlich genetisch manipulierten Mausmodellen für Brust- und Bauchspeicheldrüsenkrebs – nachgewiesen. Die Modulation über CRISPR ermöglicht zudem, den Prozess reversibel zu steuern und unter bestimmten Bedingungen ein- oder auszuschalten, was zusätzliche Sicherheit für künftige therapeutische Anwendungen bietet.
Die Methodik ist beeindruckend in ihrer Vielseitigkeit. Nicht nur klassische Metaboliten wie Glukose und Fettsäuren werden von den modifizierten Adipozyten gebunden und verbraucht, sondern auch andere substratabhängige Pathways können gezielt adressiert werden. So konnte beispielsweise beim Bauchspeicheldrüsenkrebs die Hochregulation von Uridinphosphorylase 1 (UPP1) in Adipozyten deren Verbrauch von Uridin steigern, wodurch deren Konkurrenzdruck auf uridinabhängige Tumore erhöhte und deren Wachstum ebenfalls begrenzt wurde. Dies unterstreicht das Potential der AMT als individualisierbare Plattform, die basierend auf dem metabolischen Profil eines einzelnen Tumors maßgeschneiderte Interventionen ermöglicht. Neben der direkten Konkurrenz um Nährstoffe zeigte sich durch die Implantation der modifizierten Adipozyten auch eine Verbesserung des systemischen Stoffwechsels der Wirte in den Experimenten.
Die Tiere wiesen eine gesteigerte Sauerstoffaufnahme, bessere Glukosetoleranz sowie erhöhte Insulinsensitivität auf. Dies ist bedeutsam, da der Zusammenhang zwischen erhöhtem Insulinspiegel – auch als Hyperinsulinämie bekannt – und Krebswachstum gut belegt ist. Die Verminderung von Insulin- und Glukosespiegeln im Blut durch die Aktivierung metabolisch aktiver Fettzellen könnte somit einen zusätzlichen, systemischen anti-tumoralen Effekt erzeugen. Die Entwicklung von AMT als Therapieoption ist zusätzlich durch etablierte klinische Techniken im Bereich der Fettentnahme und -transplantation begünstigt. Liposuktion ist eine gut erprobte Methode, um Fettgewebe schonend aus dem Patienten zu gewinnen; autologe Fetttransplantationen werden bereits in rekonstruktiven und kosmetischen Eingriffen routinemäßig eingesetzt.
Durch die CRISPR-basierte gene editing Technologie können die gewonnenen Adipozyten ex vivo modifiziert und anschließend dem Patienten wieder implantiert werden. Dieser Ex-vivo-Ansatz minimiert Risiken von Immunreaktionen und langfristiger Genominstabilität, die mit anderen viralen oder systemischen Therapien verbunden sind. Über die Zelltransplantation hinaus wurden in den Studien auch neuartige Trägersysteme wie polymerbasierte Mikrowell-Gerüste entwickelt. Diese dienen nicht nur dazu, die modifizierten Organoide zusammenzuhalten und ihre Funktion zu stützen, sondern ermöglichen auch ihren späteren kontrollierten Rückbau oder Austausch. Dies erhöht die Kontrollierbarkeit und Sicherheit der Therapie deutlich.
Zusätzlich konnte gezeigt werden, dass adipöse Organoide aus Patientengewebe gewonnen und erfolgreich modifiziert werden können, um das Wachstum patienteneigener Tumororganoide in vitro und in xenograft-modellen signifikant zu hemmen. Auch in Gewebe von Menschen mit erhöhtem Brustkrebsrisiko, etwa Trägern von BRCA1/2 Mutationen, konnten die modifizierten Adipozyten die Proliferation von Präkanzerosen reduzieren. Dies legt den Grundstein für präventive Therapien in Hochrisikogruppen. Angesichts der vielfältigen metabolischen Anpassungen von Tumoren eröffnet AMT ein neues Therapiefeld, das nicht nur einzelne Metabolite isoliert angreift, sondern ein holistisches Konzept verfolgt: Mit Hilfe lebender, metabolisch aktiver Zellen wird der Nährstoffwettbewerb direkt im Tumorumfeld verstärkt. Diese Strategie ist flexibel, und basiert auf bewährter Technik, was eine schnellere Überführung in klinische Studien ermöglichen könnte.
Zu den Herausforderungen der Methode zählen mögliche Auswirkungen auf den Gesamtstoffwechsel, wie insbesondere eine unbeabsichtigte Förderung des Körpergewichtsverlustes durch gesteigerten Energieverbrauch (Cachexie), die bei längerer Anwendung auftreten könnte. Dies erfordert eine enge Überwachung und die Fähigkeit, die Therapie bei Bedarf durch kontrollierte Genexpression oder Entfernung der Implantate zu beenden. Auch die Optimierung der Adipozytenmodifikation durch gleichzeitige oder gestaffelte Aktivierung mehrerer Gene sowie Kombination mit etablierten Krebstherapien könnte die Wirkung weiter verstärken. Die Verwendung verschiedener gentechnischer Werkzeuge und Verabreichungswege erlaubt, das System individuell an Tumorcharakteristika und Patientenprofil anzupassen. Insgesamt stellt die Implantation von ingenieurtechnisch bearbeiteten Adipozyten eine wegweisende Innovation in der Krebstherapie dar.
Durch die gezielte Ausnutzung der metabolischen Bedürfnisse von Tumoren und die Funktion von Fettgewebe als Stoffwechselmotor eröffnen sich neue Chancen, die Tumorprogression zu verlangsamen oder gar zu stoppen. Die Kombination aus modernster Genmodifikation, bewährten chirurgischen Techniken und der therapeutischen Nutzung körpereigener Zellen bietet eine vielversprechende Richtung für personalisierte Krebstherapien der Zukunft. Die weiterführende Erforschung sowie klinische Studien werden zeigen, inwieweit dieses Konzept den Kampf gegen Krebs entscheidend voranbringen kann.