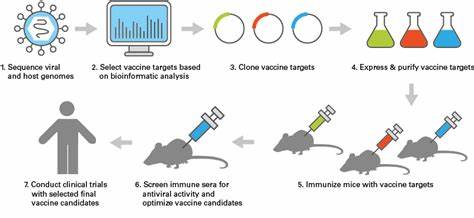
Die Entwicklung von Impfstoffen hat die moderne Medizin revolutioniert und stellt einen der bedeutendsten Fortschritte im Kampf gegen Infektionskrankheiten dar. Dennoch ist die Entwicklung von Impfstoffen nach wie vor mit erheblichen Herausforderungen verbunden, insbesondere wenn es um die Analyse und Erforschung von Viren geht. Die Vielfalt der Viren, ihre unterschiedliche Lebensweise sowie die Notwendigkeit spezieller Labors erschweren und verlangsamen den Fortschritt in der Impfstoffforschung. Eine bahnbrechende Methode namens Massively Parallel Ribosome Profiling (MPRP) verspricht, diese Hürden zu überwinden und die Erforschung viraler Proteine erheblich zu beschleunigen. Diese Methode wurde kürzlich vom Broad Institute des Massachusetts Institute of Technology und der Harvard University entwickelt und in einer Studie in der Fachzeitschrift Science vorgestellt.
Mit MPRP ist es möglich, virale Proteine schnell und sicher zu identifizieren, ohne dass die Viren selbst kultiviert werden müssen. Die Bedeutung dieser Innovation ist weitreichend, da die Kultivierung vieler Viren im Labor entweder extrem aufwendig oder gar unmöglich ist. Darüber hinaus erfordern manche Viren besondere Sicherheitsvorkehrungen, was die Forschung zusätzlich erschwert. Mit der neuen ribosomalen Profilierung wird die Virusforschung in einen neuen Entwicklungsabschnitt geführt, der nicht nur Zeit spart, sondern auch neue Erkenntnisse über die Komplexität viraler Genexpression liefert. Die Methode basiert darauf, tausende kurze Sequenzfragmente viraler Genome zu synthetisieren, diese in Plasmide zu klonieren und in menschliche Zellen einzuschleusen.
So lässt sich unter sicheren Bedingungen erforschen, welche viralen RNA-Abschnitte tatsächlich von den Ribosomen in Proteine übersetzt werden. Denn Ribosomen sind die zellulären Maschinen, die RNA-Vorlagen in Proteine umwandeln, und die Position der Ribosomen auf der viralen RNA liefert direkte Hinweise auf aktiv genutzte offene Leserahmen (ORFs) der Viren. Das ist deshalb so wichtig, weil viele virale Proteine bisher unbekannt waren, insbesondere solche, die in nichtkanonischen ORFs codiert werden. Nichtkanonische ORFs beginnen häufig nicht mit dem typischen Startcodon ATG und tragen zur Vielfalt der viralen Proteome bei. Durch das Ribosomenprofiling konnten die Forscher über 4.
200 bisher unannotierte ORFs in 679 humanen Viren identifizieren. Diese neu entdeckten Peptide eröffnen ein bislang weitgehend unerschlossenes Feld in der Virologie und Immunologie. Einige der erkenntlichen viralen Proteine aus den nichtkanonischen Bereichen wurden sogar als Peptide auf den class-I Humanleukozyten-Antigenen (HLA) von infizierten Zellen nachgewiesen. Diese Antigen-Präsentation ist zentral für die Erkennung von Virusinfektionen durch das Immunsystem und bietet somit potenzielle neue Angriffspunkte für Impfstoffe. Außerdem wurden hunderte sogenannte „upstream ORFs“ (uORFs) entdeckt, die eine Regulierung der viralen Proteinproduktion einleiten könnten.
Dies zeigt ein komplexeres Bild der viralen Translation und eröffnet Möglichkeiten, diese Mechanismen therapeutisch zu beeinflussen. Die Fähigkeit, viral exprimierte Proteine in großem Maßstab und über eine Vielzahl von Viren hinweg zu identifizieren, beschleunigt nicht nur das Verständnis viraler Lebenszyklen, sondern bietet auch eine innovative Plattform für zukünftige Impfstoffentwicklungen. Besonders im Hinblick auf aufkommende Viren und Pandemien ist der Nutzen von MPRP enorm, da eine schnelle und sichere Bewertung viraler Proteine erfolgt, ohne dass das infektiöse Virus selbst gehandhabt werden muss. Die Methode ist viral-agnostisch, das heißt, sie ist nicht auf eine spezifische Virusfamilie begrenzt und kann für zahlreiche Virenklassen genutzt werden. Dies erlaubt eine flexible und skalierbare Anwendung in der Grundlagenforschung und der präklinischen Entwicklung.
Darüber hinaus könnte MPRP dazu beitragen, virale Translation unter unterschiedlichen zellulären Bedingungen zu untersuchen, was weitere Erkenntnisse über Virus-Wirt-Interaktionen verspricht. Während MPRP bereits Tausende von neuen ORFs aufgedeckt hat, bleibt ein großer Teil dieser Regionen noch unklassifiziert und wird derzeit weiter erforscht. Dies zeigt das Potenzial dieser Technologie, neue Aspekte der Virenbiologie zu entdecken. Die Konsequenzen daraus sind weitreichend: Ein besseres Verständnis viraler Proteine kann nicht nur die Identifikation neuer Impfstoffkandidaten erleichtern, sondern auch die Entwicklung antiviraler Therapien mit bislang unbekannten Angriffspunkten fördern. Die Herausforderung beim Design von Impfstoffen besteht oft darin, virale Antigene zu erkennen, die vom Immunsystem effektiv erkannt und bekämpft werden.
Die neu entdeckten Proteine aus nichtkanonischen ORFs bieten hier eine ganz neue Klasse potenzieller Targets. Die schnelle Erfassung dieser Proteinlandschaft kann die Impfstoffentwicklung deutlich beschleunigen und dazu beitragen, besser gegen sich schnell verändernde oder neu auftretende Viren gewappnet zu sein. In einem breit angelegten Kontext bietet MPRP somit eine neuartige Forschungsplattform, die weit über die bisherigen Möglichkeiten der Genomsequenzierung hinausgeht. Während Sequenzierung Aufschluss über die genetische Information gibt, liefert ribosomales Profiling einen direkten Einblick, welche Gene tatsächlich für Proteine genutzt werden – eine entscheidende Information für die funktionelle Analyse von Viren. Durch die Kombination von biotechnologischer Innovation, molekularer Biologie und Hochdurchsatztechnologie gelingt es nun, die proteomische Landschaft von Viren umfassend zu kartieren und so neue Wege in der Infektionsforschung zu eröffnen.
Zusammenfassend kann gesagt werden, dass die Massively Parallel Ribosome Profiling-Methode eine innovative Antwort auf die komplexen Probleme der Impfstoffentwicklung darstellt. Sie bietet nicht nur ein schnelleres, sichereres und vielseitigeres Werkzeug zur Erforschung viraler Proteine, sondern eröffnet auch neue Perspektiven für die Immunisierung gegen eine Vielzahl von Viruserkrankungen. Mit dieser Technologie kann die Impfstoffentwicklung in Zukunft effizienter und zielgerichteter gestaltet werden, was angesichts der globalen Bedrohung durch Infektionskrankheiten von enormer Bedeutung ist. Der Fortschritt unterstreicht einmal mehr die Bedeutung von interdisziplinärer Forschung und modernster Biotechnologie, um den Herausforderungen moderner Viruserkrankungen wirksam zu begegnen und Gesundheitssysteme weltweit zu stärken.