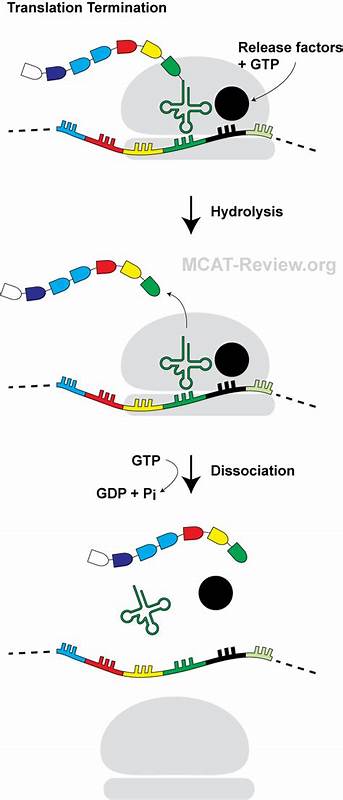
Die Translation ist ein fundamentaler biologischer Prozess, bei dem die in der DNA codierte Information in funktionelle Proteine übersetzt wird. Dabei spielt die korrekte Terminierung der Translation am Stop-Codon eine entscheidende Rolle. Nachdem die Ribosomen die Aminosäuresequenz eines Proteins synthetisiert haben, erkennen spezifische Freisetzungsfaktoren die Stop-Codons und lösen die Freisetzung der fertigen Polypeptidkette aus. In den letzten Jahren hat die Forschung zunehmend die Bedeutung von naszierenden Peptiden erkannt, die innerhalb des Ribosoms besondere Strukturen ausbilden und dadurch die Translation auf unterschiedliche Weise beeinflussen können. Ein bemerkenswertes Beispiel sind Mini-Haarnadel-Peptide, die durch eine einzigartige Faltung die Terminierung der Translation blockieren können und somit eine bisher unbekannte Form der Regulation darstellen.
Die Entdeckung und Charakterisierung solch eines Mini-Haarnadel-Peptids, bekannt als PepNL, in Escherichia coli eröffnet ein faszinierendes Bild, wie kleine Peptidsequenzen innerhalb des Ribosoms eine selbstregulative Funktion übernehmen. Das Besondere an PepNL ist seine Fähigkeit, die Translation am Stop-Codon zu verzögern, ohne auf externe Moleküle, sogenannte Arrest-Inducer, angewiesen zu sein – ein Mechanismus, der von konventionellen naszierenden Peptiden abweicht. PepNL besteht aus 14 Aminosäuren und entfaltet bei der Translation eine charakteristische mini-Haarnadel-Struktur in der Ribosomen-Austrittstunnelregion. Diese Mini-Haarnadel faltet sich nach innen, wodurch die N-Terminus-Sequenz zurück Richtung Ribosomenbasis zeigt, im Gegensatz zur üblichen Ausrichtung vom Tunnel weg. Diese ungewöhnliche Faltung führt zu einer Verzerrung im C-terminalen Bereich des Peptids, besonders an der Stelle des Iso-Leucin-Rests an Position 13, der eine zentrale Rolle im Mechanismus spielt.
Strukturelle Studien mittels Kryo-Elektronenmikroskopie enthüllten, dass die Mini-Haarnadel von PepNL eine physische Blockade am aktiven Zentrum des Peptidyl-Transferase-Komplexes bewirkt. Die Peptidstruktur kollidiert direkt mit dem GGQ-Motiv des Freisetzungsfaktors RF2, welches normalerweise an der Hydrolyse der Esterbindung zwischen dem neuentstehenden Polypeptid und der tRNA beteiligt ist. Dieser sterische Konflikt hindert den Freisetzungsfaktor daran, seine katalytische Funktion auszuführen, sodass die Translationsterminierung gestoppt wird und das Ribosom in einem arretierten Zustand verbleibt. Ein wesentlicher Unterschied zu anderen bekannten Arrest-Peptiden besteht darin, dass PepNL keinen metabolischen Liganden oder ein anderes Molekül als Arrest-Inducer benötigt, um seine Funktion auszuüben. Stattdessen wird die Arrestwirkung durch die Verfügbarkeit von Tryptophan reguliert.
Das Vorhandensein von Tryptophanyl-tRNA (Trp-tRNATrp) bewirkt ein sogenanntes Stop-Codon-Read-Through, bei dem das UGA-Stopcodon durch Einbau von Tryptophan übersprungen wird, sodass die Translation fortschreiten kann. Somit stellt Tryptophan hier keinen Arrest-Inducer dar, sondern wirkt im Gegenteil als Arrest-Inhibitor. Diese Regulationsform ist bemerkenswert, da sie zeigt, wie eine Naszentkette durch ihre spezifische Faltung und durch Wechselwirkung mit dem Translationsterminationsmechanismus eine direkte Rückkopplung auf sich selbst und den Übersetzungsprozess ausübt. Das Modell schlägt vor, dass unmittelbar nach der Synthese des Peptids die Mini-Haarnadel-Struktur noch nicht vollständig ausgebildet ist. In diesem Zeitraum kann das Ribosom mit Hilfe von Trp-tRNATrp das Stopcodon überlesen und die Translation fortsetzen, bevor der Arrestmechanismus voll wirksam wird.
Sobald die Mini-Haarnadel jedoch gefaltet ist, blockiert sie effektiv die Termination. Darüber hinaus beeinflusst die PepNL-Haarnadel nicht nur die Termination durch RF2, sondern beeinträchtigt auch die Akzeptanz bestimmter Aminoacyl-tRNAs, was auf eine weiträumige Wirkung im Peptidyl-Transferase-Zentrum hindeutet. Die Wechselwirkungen mit bestimmten Ribosomen-RNA-Nukleotiden stabilisieren die Haarnadelkonformation und tragen zu ihrer Arrestfunktion bei. Die biologische Bedeutung dieser neuartigen Arrestmechanismen lässt sich auf mehreren Ebenen diskutieren. Zum einen ermöglicht die kontrollierte Verzögerung der Termination eine feine Regulation der Genexpression, da durch die Translation von PepNL die Expression des nachfolgenden pepN-Gens beeinflusst wird.
PepN kodiert für eine Aminopeptidase, die eine Schlüsselrolle im Aminosäurestoffwechsel und in der Anpassung an Umweltveränderungen spielt. Die Translation des upstream PepNL-peptids wirkt somit regulatorisch auf die Funktion von PepN und könnte in Stress- oder Nährstoffmangelphasen eine schnelle Reaktion auf veränderte Bedingungen ermöglichen. Zum anderen erweitern die Erkenntnisse über PepNL das Verständnis von Ribosomen als aktive Regulatoren und nicht bloß passive Proteinproduzenten. Ribosomen und naszierende Peptide interagieren dynamisch, um nicht nur die Korrektheit der Proteinsynthese sicherzustellen, sondern auch auf metabolische Zustände und Umwelteinflüsse zu reagieren. Methoden wie LC-MS/MS zur Analyse peptidyl-tRNA-Komplexe und Ribosomenprofilierungen unter laborähnlichen Bedingungen trugen maßgeblich zur Entdeckung von PepNL und ähnlichen Arrestpeptiden bei.
Diese Technologien erlauben es, die genaue Sequenz und den Status der naszierenden Peptide im Ribosom zu erfassen und Einblicke in ihre Auswirkungen auf die Translation zu gewinnen. In der Zukunft könnten weitere Untersuchungen zeigen, wie weit verbreitet diese Art von Mini-Haarnadel-Arrestpeptiden in verschiedenen Organismen ist und welche physiologischen Rollen sie jeweils einnehmen. Ebenso bleibt offen, inwiefern diese Mechanismen bei Pathogenen, insbesondere Bakterien, zur Anpassung an Wirts- oder Umweltbedingungen beitragen. Darüber hinaus bieten die Ergebnisse ein neues Konzept für die Entwicklung von Antibiotika oder biotechnologischen Werkzeugen. Peptide oder Moleküle, die gezielt Translationsterminationen blockieren oder modulieren, könnten genutzt werden, um das Wachstum von Krankheitserregern zu beeinflussen oder proteinbasierte Systeme kontrolliert zu steuern.



![Dawkins Re-Examined [video]](/images/E09A76FE-A75D-4E7C-8E74-27A30375A706)