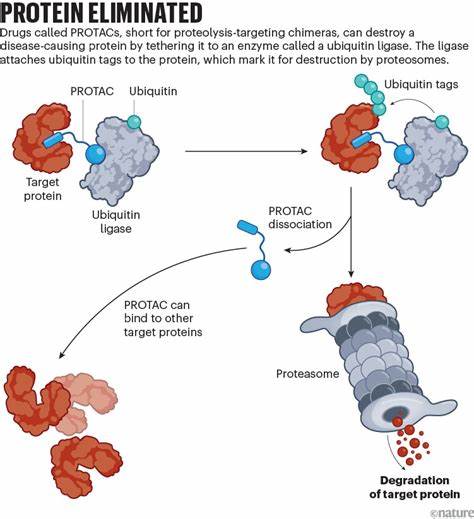
Krebs ist eine der herausforderndsten Krankheiten unserer Zeit. Trotz der vielen Fortschritte in der Onkologie gibt es immer noch Krebsarten, die besonders aggressiv verlaufen und schwer zu therapieren sind. Gerade bei kindlichen Krebserkrankungen, wie Neuroblastomen oder anderen soliden Tumoren, sind die Behandlungsmöglichkeiten bislang begrenzt und oft mit starken Nebenwirkungen verbunden. Die Forschung steht nun an einem vielversprechenden Wendepunkt: Protein-Slayer-Medikamente, auch bekannt als PROTACs (Proteolysis-Targeting Chimeras), könnten die Zukunft der Krebsbehandlung grundlegend verändern und neue Wege eröffnen, bisher als „unbehandelbar“ geltende Krebsproteine zu eliminieren. PROTACs sind innovative synthetische Moleküle, die eine ganz neue Behandlungsstrategie verfolgen.
Klassische Krebsmedikamente wirken oft durch Hemmung der Funktion eines spezifischen Proteins, indem sie sich an eine aktive Stelle auf dem Protein setzen und dessen Wirkung blockieren. PROTACs gehen noch einen Schritt weiter: Sie bringen das Zielprotein direkt in die zelluläre „Müllabfuhr“, indem sie das Protein markieren und so seinem Abbau durch die körpereigene Ubiquitin-Proteasom-System zuführen. Diese Methode ermöglicht es, krankheitsverursachende Proteine komplett zu vernichten und damit ihre Rolle in der Krebsentstehung und -ausbreitung vollständig auszuschalten. Die Besonderheit dieser Technologie liegt darin, dass sie eine Vielzahl von Proteinen angreifbar macht, die bislang als „undruggable“ galten. Viele Proteine sind für etablierte Medikamente schwer zugänglich, da sie keine geeigneten Bindungsstellen für klassische Hemmstoffe besitzen.
PROTACs hingegen benötigen lediglich die Fähigkeit, an das Zielprotein anzudocken, und die Zelle übernimmt dann den weiteren Abbauprozess. Dadurch erweitert sich das therapeutische Spektrum deutlich, was besonders für seltene und komplexe Krebsarten von großer Bedeutung ist. Ein Beispiel für die Dringlichkeit neuer Therapieansätze sind neuroblastome, kindliche Tumore des Nervengewebes, die oft mit einer schlechten Prognose verbunden sind. Erschwerend kommt hinzu, dass Kinder mit diesen Krebsarten eine andere Biologie aufweisen als Erwachsene, weshalb für sie eigene, spezifische Therapien entwickelt werden müssen. Hier setzen Forscherinnen und Forscher verstärkt auf PROTACs, um spezielle Krebsproteine anzugreifen, die das Wachstum und die Ausbreitung der Tumore fördern.
Unter diesen Proteinen befindet sich der Transkriptionsfaktor MYCN, der eine zentrale Rolle bei mehreren aggressiven kindlichen Krebserkrankungen spielt. MYCN gilt als besonders schwierig zu behandeln, da herkömmliche Medikamente kaum an ihn binden können. Der Einsatz von PROTACs gegen solche „dunklen Proteine“ könnte eine neue Ära in der Behandlung von Krebs einläuten. Das zugrundeliegende Wirkprinzip ist einfach und doch genial: PROTACs fungieren als molekulare Verbindungsbrücken zwischen dem Zielprotein und einem Ubiquitin-Ligase-Enzym, das das Zielprotein mit einem Ubiquitin-Stempel versieht und es so für den Abbau markiert. Anschließend wird das Protein vollständig zerstört, was die Krebszelle schwächt oder gar zum Absterben bringt.
Diese „Abschussmethode“ hat den Vorteil, effizienter zu sein als eine bloße Blockade der Proteinaktivität und kann resistenten Tumoren besser entgegenwirken. Der Entwicklungsweg der PROTACs war jedoch lang und mit Herausforderungen verbunden. Die ersten Modelle entstanden bereits im Jahr 2001, wurden aber anfangs eher skeptisch betrachtet. Forscher hatten Schwierigkeiten, die Moleküle so klein und zellgängig zu gestalten, dass sie effektiv in die Krebszellen eindringen konnten. Erst mit bedeutenden Fortschritten ab 2015 gelang es, PROTACs herzustellen, die eine nahezu vollständige Degradierung von Zielproteinen in Zellen und Tiermodellen bewirkten.
Seitdem hat sich das Potenzial dieser Technologie deutlich gezeigt und eine Vielzahl von pharmazeutischen Unternehmen arbeitet intensiv an der klinischen Entwicklung. Aktuell sind mehr als 30 PROTACs in klinischen Studien, vor allem bei verschiedenen Krebsarten wie Brustkrebs, Prostatakrebs und Leukämien. Erste vielversprechende Ergebnisse liegen aus Phase-III-Studien vor, die den Weg zur Zulassung für den Marktberecht öffnen könnten. Dabei werden vor allem bisher bekannte Proteine angegriffen, gegen die es bereits Medikamente gibt, mit dem Ziel, Therapieresistenzen zu überwinden oder Nebenwirkungen zu verringern. Ein besonders ambitioniertes Forschungsvorhaben verfolgt ein internationales Team unter der Leitung der Kinderonkologin Yael Mossé.
Das Team konzentriert sich auf schwer behandelbare kindliche Solidtumore wie Neuroblastome, Hirntumore sowie Knochen- und Lebertumore. Die Wissenschaftlerinnen und Wissenschaftler entwickeln PROTACs, die gegen neuartige, bisher sogenannte „undruggable“ Proteine gerichtet sind. Unterstützt wird das Vorhaben durch internationale Kooperationen, Förderungen von Stiftungen und Patientenvertretungen. Auch Familien von betroffenen Kindern engagieren sich, nachdem sie den Leidensweg an der eigenen Haut erlebt haben und einen Beitrag zur verbesserten Behandlung künftiger Patienten leisten möchten. Der Fokus liegt dabei nicht nur auf der Wirksamkeit der Medikamente, sondern auch auf deren Erschwinglichkeit und Verabreichungsfreundlichkeit.
Denn insbesondere in Ländern mit begrenztem Zugang zu medizinischer Versorgung kann der Preis eine entscheidende Rolle spielen. Ziel ist es deshalb, Therapien zu entwickeln, die kostengünstig hergestellt werden können und sich leichter anwenden lassen als bisherige längere, oft belastende Krankenhausbehandlungen. Neben den bekannten Herausforderungen der Krebsbehandlung – wie Tumorresistenz und genetische Vielfalt der Krebszellen – bieten PROTACs auch die Möglichkeit, sogenannte Fusionsproteine gezielt anzugreifen. Fusionsproteine entstehen aus abnormen Genfusionen und sind bei vielen Leukämien, Lymphomen und kindlichen Solidtumoren kausal für das Fortschreiten der Krankheit. Diese Proteinfusionen sind bisher kaum therapierbar, weil sie einzigartige Strukturen aufweisen.
PROTACs könnten hier gezielt ansetzen und so eventuell völlig neue Behandlungsmöglichkeiten eröffnen. Die Forschung an PROTACs steht beispielhaft für die starke dynamische Entwicklung in den Biowissenschaften. Immer häufiger entstehen multidisziplinäre Zusammenarbeit zwischen Chemikern, Biologen, Medizinern und Patientenvertretern, die das Potenzial dieser Technologie gemeinsam vorantreiben. Während die Pharmaindustrie das Feld zunehmend aufgreift und eigene Programme zur Proteindegradierung aufbaut, entsteht eine globale Forschungscommunity mit einem gemeinsamen Ziel: Bessere, zielgerichtete und nachhaltige Therapien für bislang sehr schwierig behandelbare Krebserkrankungen. Auch wenn noch kein PROTAC offiziell zugelassen ist, sind die bisherigen Fortschritte vielversprechend.
Expertinnen und Experten sind zuversichtlich, dass die nächsten Jahre einen entscheidenden Durchbruch bringen könnten. Neben Krebs könnten PROTACs auch bei neurodegenerativen Erkrankungen wie Parkinson sowie bei chronisch-entzündlichen Leiden und Schmerzen Anwendung finden. Die Vision ist klar: Durch gezielte Eliminierung schädlicher Proteine statt bloßer Hemmung soll eine präzisere und nachhaltigere Behandlung möglich werden. Für Patientinnen und Patienten, insbesondere Kinder mit aggressiven Krebserkrankungen, könnte das eine Revolution im Kampf gegen diese lebensbedrohlichen Krankheiten bedeuten. Die Hoffnung auf Heilung oder zumindest deutlich verbesserte Lebensqualität wächst durch diese neuartige Therapieform enorm.
Insgesamt zeigen die Entwicklungen im Bereich der Protein-Slayer-Medikamente eindrucksvoll, wie biologisches Verständnis und chemische Innovation zusammenwirken können, um neue Therapien hervorzubringen. Während die Forschung weiter voranschreitet, bleibt die medizinische Gemeinschaft wachsam und engagiert, um dieses große Versprechen für Patientinnen und Patienten weltweit Wirklichkeit werden zu lassen.