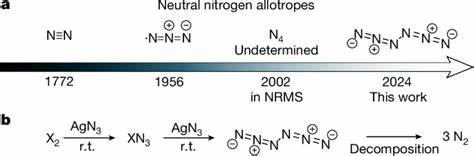
Die Chemie des Stickstoffs gilt seit jeher als faszinierendes Forschungsfeld – nicht zuletzt aufgrund seiner Bedeutung in der Natur und Technologie. Stickstoff ist das häufigste Element in der Erdatmosphäre, vor allem in Form des molekularen zweiatomigen Stickstoffes (N2), das aufgrund seiner stabilen Dreifachbindung als sehr inert gilt. Trotz zahlreicher theoretischer Ansätze blieb die Gewinnung neutraler, höherer Stickstoff-Allotrope lange ein ungelöstes Problem. Die Synthese eines neutralen Hexanitrogenmoleküls mit der Symmetrie C2h-N6 ist daher ein großer Durchbruch, der neue Perspektiven im Bereich der chemischen Energiespeicherung und hochenergetischer Materialien bietet.Interessant ist, dass polynitrogene Verbindungen, bestehend ausschließlich aus Stickstoffatomen, eine sehr hohe Energiedichte aufweisen.
Die Energie, die durch deren Zerfall in das stabile N2-Molekül freigesetzt wird, übertrifft die von Wasserstoff oder Ammoniak bei weitem. Gleichzeitig entsteht bei der Zersetzung ausschließlich umweltfreundlicher Stickstoff, was diese Materialien besonders reizvoll für nachhaltige Energiekonzepte macht. Die Herausforderung bei all diesen Verbindungen ist jedoch die extrem hohe Instabilität, die ihre praktische Anwendung bislang stark beschränkte.Die erstmalige Herstellung von neutralem Hexanitrogen erfolgt durch eine raffinierte Reaktionsmethode, bei der Chlorgas oder Bromgas mit Silberazid (AgN3) im Gaszustand bei Raumtemperatur reagieren. Anschließend wird das Reaktionsgemisch durch schnelle Abkühlung bei extrem niedrigen Temperaturen in Argonmatrizen bei etwa 10 Kelvin eingefangen.
Diese Technik ermöglicht es, die kurzlebigen Moleküle zu stabilisieren und zu untersuchen. Darüber hinaus konnte reines N6 auch als dünner Film bei flüssigem Stickstoff (77 Kelvin) präpariert werden, was auf eine unerwartete thermische Stabilität dieses Allotropen schließen lässt.Die valide Identifikation von C2h-N6 erfolgt durch kombinierte spektroskopische Methoden wie Infrarot- und UV-Vis-Spektroskopie, unterstützt durch Isotopenmarkierungs-Experimente mit dem stabilen Stickstoffisotop 15N. Die spektroskopischen Signale stimmen hervorragend mit theoretischen Berechnungen ab initio überein, wodurch die Existenz des neuen Moleküls überzeugend bestätigt wird. Die speziellen experimentellen Bedingungen, insbesondere die Matrixisolation bei tiefen Temperaturen, machen die Untersuchung dieser ansonsten hochreaktiven Spezies möglich.
Theoretisch ist das Molekül als acyclisches Hexanitrogen mit der Lewis-Struktur einer 1,2,4,5-Tetraen-Diazid-Form gut beschrieben. Im Gegensatz zu früher durch theoretische Studien postulierten Strukturen, die meist sehr geringe Energiebarrrieren gegen Zerfall aufweisen, zeigt C2h-N6 eine überraschende kinetische Stabilität mit einem berechneten Aktivierungsenergiebarriere gegen Zerfall in drei N2-Moleküle von rund 14,8 kcal/mol. Diese Barriere erlaubt das kurzzeitige Überleben des Moleküls selbst bei Raumtemperatur und ist damit deutlich höher als bei vielen anderen Polynitrogenverbindungen.Die quantenmechanischen Berechnungen verwenden hochauflösende Methoden wie CCSD(T) mit umfangreichen Basissets, um präzise Geometrien und Energieprofile zu bestimmen. Die Struktur von Hexanitrogen zeigt charakteristische Bindungslängen, die zwischen einfachen Einfach- und Doppelbindungen liegen, was sich durch ausführliche Analysen der Elektronendichte und Natural-Bond-Orbital-Berechnungen manifestiert.
Die Ladungsverteilung ist zudem ausgewogen, wobei einige Stickstoffatome kleine positive und andere kleine negative Partialladungen tragen, was zur Stabilität des Moleküls beiträgt.Neben der fundamentalen Bedeutung dieser Entdeckung für die Chemie erweitert Hexanitrogen das Spektrum der bekannten neutralen Stickstoffallotrope – bislang waren nur der Azidradikal (•N3) und das sogar sehr selten kartographierte N4 bekannt. Die erstmalige experimentelle Evidenz des N6-Moleküls bricht das Dogma, dass neutrale längerkettige Stickstoffverbindungen aufgrund ihrer hohen Reaktivität niemals isolierbar wären.Von besonderem Interesse ist das enorme Energiespeicherpotenzial von C2h-N6. Die theoretisch berechnete Enthalpie der Zerlegung in N2 beträgt mehr als 185 kcal/mol, was bei gleichem Gewicht etwa das Doppelte der typischen Zersetzungsenergie von TNT darstellt.
Die Dichte des hypothetischen kristallinen Materials wird auf etwa 1,5 g/cm³ geschätzt, was Detonationsgeschwindigkeiten und -drücke hervorruft, die mit oder sogar über denen bekannter galionsfigurer Sprengstoffe wie RDX liegen. Daraus ergibt sich ein erhebliches Anwendungspotenzial in Bereichen der Hochenergiestoffe und in der grünen Energiespeicherung.Die Synthese von C2h-N6 erfordert aufgrund der Explosivstoffeigenschaften der Ausgangsmaterialien wie Silberazid und Halogenazide äußerste Sicherheitsmaßnahmen und präzise Kontrolle der Reaktionsparameter. Die Reaktion erfolgt unter vermindertem Druck und direktem Kontakt von gasförmigem Halogen mit festem Silberazid. Die anschließende schnelle Abkühlung und Matrixstabilisierung ermöglicht den Erhalt des Produktes für spektroskopische Untersuchungen.
Die Identifizierung der charakteristischen Infrarot-Banden, insbesondere im Bereich der Azid-typischen Schwingungen, erfolgt durch Vergleich mit Rechenmodellen. Isotopenersatz durch 15N verschiebt die entsprechenden Signalpositionen erwartungsgemäß und bestätigt die Struktur. Die UV-Vis-Spektroskopie zeigt außerdem elektronische Übergänge, die mit time-dependent DFT-Berechnungen übereinstimmen und Einblick in die elektronische Struktur geben. Die Photochemie des Moleküls bei Bestrahlung weist auf einem π→π*-Übergang hin, der durch das Experiment unterstützt wird.Das Vorhandensein eines Metastabilitätsfensters, in dem C2h-N6 bei tiefen Temperaturen als reiner Film stabil existiert, eröffnet Möglichkeiten für eine zukünftige Materialforschung zur Entwicklung neuartiger, stickstoffbasierter Energiespeicher oder Sprengstoffe.
Vor allem ist die Tatsache beachtlich, dass trotz der hohen Energiedichte und theoretischen Vorhersagen von Quantum Mechanical Tunneling der Zerfall unter experimentellen Bedingungen stark verzögert ist.Die Entdeckung von neutralem Hexanitrogen schließt auch eine Lücke zwischen den bereits bekannten ionischen Stickstoffpolymeren und den bisher theoretisch postulierten, aber schwer zugänglichen neutralen Molekülen. Zudem regt sie die Forschung an, andere Allotrope mit ähnlichen oder noch größeren Kohlenstoffstrukturen zu synthetisieren, die vielleicht ebenso stabil und energiereich sind.Neben der energietechnischen Bedeutung stellt die Arbeit rund um C2h-N6 auch einen Meilenstein im Bereich der Grundlagenchemie dar. Sie zeigt, dass selektive Reaktionen unter sorgfältig kontrollierten Bedingungen selbst in einem so schwierigen System wie der reinen Stickstoffchemie erfolgreiche Synthesen ermöglichen können.


![Bidirectional German Escalator [video]](/images/66130242-9C49-44D2-9E08-51E68407FDB3)