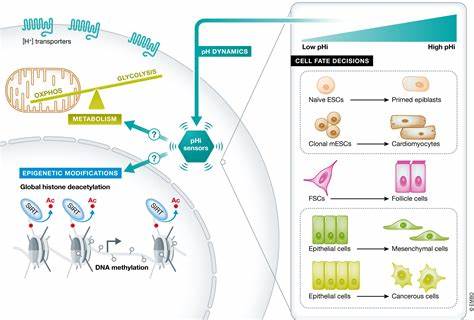
Die Fähigkeit des Körpers, beschädigtes Gewebe zu regenerieren, ist eine faszinierende und komplexe Aufgabe, die weit über die reine Zellteilung hinausgeht. Neue wissenschaftliche Erkenntnisse zeigen, dass metabolische Anpassungen eine entscheidende Rolle bei der Festlegung des Zellschicksals während der Geweberegeneration spielen. Insbesondere die unterschiedlichen Stoffwechselwege innerhalb von Zellen beeinflussen maßgeblich, ob eine Zelle zu einer bestimmten Funktionseinheit heranreift oder einen alternativen Weg einschlägt. Dieses Konzept gewinnt in der regenerativen Medizin zunehmend an Bedeutung, da ein genaueres Verständnis der metabolischen Steuerungsmechanismen neue therapeutische Ansätze für eine Vielzahl von Erkrankungen eröffnet. Im Mittelpunkt dieser Forschung steht der Metabolismus der Tricarbonsäurezyklus (TCA-Zyklus), ein zentraler Stoffwechselweg, der nicht nur die Energieversorgung der Zelle sichert, sondern auch Signalmoleküle produziert, welche die Genexpression und damit die Differenzierung von Zellen regulieren.
Ein besonders bedeutsamer Metabolit ist das α-Ketoglutarat (αKG). Dieses Molekül fungiert nicht nur als Zwischenprodukt im TCA-Zyklus, sondern dient auch als Co-Faktor für eine Klasse von Enzymen, die DNA- und Chromatinmodifikationen steuern – die sogenannten αKG-abhängigen Dioxygenasen. Neue Untersuchungen am Modell der Darmepithelzellregeneration enthüllen dabei eine überraschende Heterogenität in der Expression von TCA-Zyklus-Enzymen, die auf unterschiedliche metabolische Bedürfnisse der einzelnen Zelltypen hinweist. Insbesondere wird die αKG-Dehydrogenase-Komplex-Komponente OGDH unterschiedlich reguliert: Während sie in der absorptiven Zelllinie, die für die Nährstoffaufnahme verantwortlich ist, hochreguliert ist, ist sie in den sekretorischen Zellen, deren Aufgabe die Immunabwehr und Schleimproduktion ist, deutlich herunterreguliert. Dieser Unterschied ist nicht nur ein Begleitphänomen, sondern bestimmt maßgeblich, ob sich eine Stammzelle zu einem absorptiven Enterozyten oder zu einem sekretorischen Zelltyp wie Paneth-, Goblet- oder enteroendokrinen Zellen differenziert.
Die Regulation von OGDH hängt dabei eng mit zelltyp-spezifischen Transkriptionsfaktoren zusammen. Die Hepatocyte-Nuclear-Faktor-4 (HNF4) Familie – zentrale Steuerungsmoleküle der Enterozyten-Entwicklung – fördert die Expression von OGDH, wodurch der TCA-Zyklus für Energiebedarf und Biosynthese optimal genutzt wird. Im Gegensatz dazu führt die Herunterregulierung von OGDH zu einer Anreicherung von αKG, was wiederum die Aktivität von αKG-abhängigen Dioxygenasen steigert. Dies führt zu weitreichenden epigenetischen Veränderungen, die die Zelle Richtung des sekretorischen Zellschicksals lenken. Experimentelle Daten aus genetisch modifizierten Mausmodellen und Darmorganoiden unterstützen diese funktionale Trennung.
Durch gezielte Herunterregulierung von OGDH konnte gezeigt werden, dass absorptive Vorläuferzellen stark unter Energie- und Biosyntheseengpässen leiden, was zu Wachstumsstopp und Zelltod führt. Sekretorische Zelllinien hingegen tolerieren die reduzierte OGDH-Aktivität gut und können sich sogar verstärkt differenzieren. Die Gabe von αKG in Zellkulturen oder lebenden Organismen förderte wiederum die Differenzierung in die sekretorische Zelllinie und unterstützte die Geweberegeneration. Die Bedeutung dieser Erkenntnisse zeigt sich besonders in der Krankheitsmodellierung von Darmerkrankungen wie Colitis ulcerosa oder Morbus Crohn, die durch chronische Entzündungen und Störungen der zellulären Regeneration gekennzeichnet sind. Hier kommt es häufig zu einer verminderten Anzahl sekretorischer Zellen, die wichtige Funktionen für die Schleimbarriere und Immunregulation erfüllen.
Studien zeigen, dass bei Entzündungen die Expression von OGDH häufig ansteigt, was mit sinkenden αKG-Spiegeln, einem Mangel an epigenetischen Markern und eingeschränkter Differenzierung korreliert. Therapeutisch eröffnen sich durch die Manipulation des αKG-Stoffwechsels neue Perspektiven. Sowohl die Hemmung von OGDH als auch die Supplementierung mit αKG konnte im Mausmodell der entzündlichen Darmerkrankung die Regeneration fördern, die Anzahl sekretorischer Zellen erhöhen und die kolitische Inflammation mindern. Dabei zeigen sich signifikante Verbesserungen der Gewebearchitektur, verminderte Ulzerationen und eine schnellere Wiederherstellung der Darmfunktion. Darüber hinaus ist αKG nicht nur ein metabolischer Faktor, sondern fördert auch die sogenannte regenerative Plastizität – die Fähigkeit sekretorischer Vorläuferzellen, sich zurück in funktionelle Stammzellen zu verwandeln und so den Darmepithelpool zu erneuern.
Der Einfluss des Stoffwechsels auf Zellschicksale ist dabei ein Beispiel für das immer klarer werdende Zusammenspiel von Metabolismus und epigenetischer Regulation. αKG-abhängige Dioxygenasen tragen zur DNA-Demethylierung bei und modulieren damit direkt die Expressionsprofile von Genen, die für die Zellidentität entscheidend sind. Somit ist Metabolismus nicht nur eine Folge der Zellfunktion, sondern auch ein aktiver Treiber von Differenzierung und Geweberegeneration. Darüber hinaus widerlegt diese Forschung die lange Zeit geltende Annahme, dass Kernkomponenten des Zellstoffwechsels unveränderlich und in allen Zelltypen gleichmäßig exprimiert werden. Tatsächlich zeigen die Untersuchungen am Darm, wie wichtig eine feine, zelltypspezifische Regulation von zentralen Enzymen für die Aufrechterhaltung der Gewebefunktion ist.
Diese Erkenntnis ist für das allgemeine Verständnis der Zellbiologie von großer Bedeutung und könnte auf andere Organsysteme und regenerative Prozesse übertragbar sein. Daher gewinnen metabolische Interventionen zunehmend an Aufmerksamkeit als potenzielle therapeutische Strategie. Die gezielte Beeinflussung von metabolischen Enzymen oder deren Produkten bietet die Möglichkeit, differenzielle Zellschicksale zu steuern, das Gleichgewicht verschiedener Zelltypen zu erhalten oder wiederherzustellen und damit Erkrankungen, die durch Zellfunktionsstörungen gekennzeichnet sind, zu behandeln oder Heilungsprozesse zu beschleunigen. Neben Darmerkrankungen könnten ähnliche Mechanismen auch bei anderen regenerativen Herausforderungen wie Lebererkrankungen, Hautverletzungen oder neurologischen Erkrankungen eine Rolle spielen. Das Prinzip der metabolisch gesteuerten Differenzierung eröffnet somit ein neues Forschungsfeld mit breiten Implikationen in Biologie und Medizin.