Die Krebsforschung steht vor der gewaltigen Herausforderung, effektive und zugleich nachhaltige Therapien zu entwickeln, die gezielt das Tumorwachstum eindämmen, ohne den gesamten Organismus zu schädigen. Jüngste Durchbrüche zeigen, dass gentechnisch veränderte Fettzellen, sogenannte Adipozyten, dafür ein ganz besonders vielversprechendes Potenzial besitzen. Das Verfahren, bei dem diese Zellen in betroffenen Geweben implantiert werden, unter dem Begriff adipose manipulation transplantation (AMT) bekannt, verspricht einen neuen Weg in der Krebsbehandlung zu eröffnen. Die Grundidee ist faszinierend: Tumorzellen benötigen für ihr unkontrolliertes Wachstum große Mengen an Energie und Nährstoffen, vor allem Glukose und Fettsäuren. Gentechnisch modifizierte Adipozyten werden so programmiert, dass sie diese Nährstoffe effizient aufnehmen und verwerten, wodurch sie den Tumorzellen quasi die Lebensgrundlage entziehen und dadurch deren Wachstum hemmen.
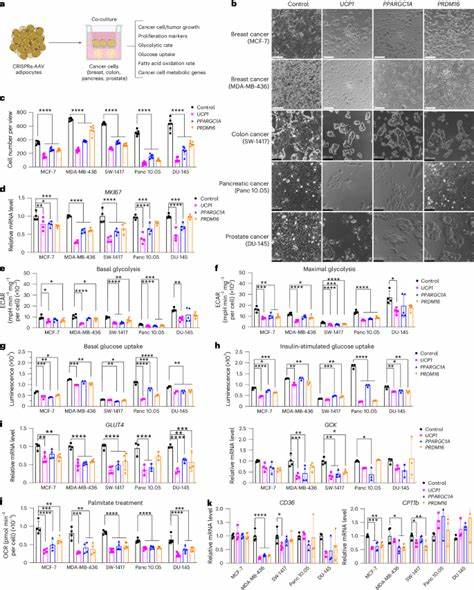
Die Schlüsselrolle spielt dabei das Gen UCP1, ein zentraler Akteur im Stoffwechsel von braunem Fettgewebe, das für die Energieverbrennung und Wärmeerzeugung verantwortlich ist. Durch die gezielte Aktivierung von UCP1 und anderer regulatorischer Gene in weißen Fettzellen werden diese in funktionale braune oder beige Adipozyten umgewandelt. So gewinnen sie die Fähigkeit, mehr Glukose und Fettsäuren aufzunehmen und ihren Verbrauch zu erhöhen. In vitro-Studien mit verschiedenen Krebszelllinien, darunter Brust-, Darm-, Pankreas- und Prostatakrebszellen, ergeben nach Ko-Kultur mit diesen genetisch modifizierten Adipozyten eine signifikante Reduktion der Zellproliferation. Neben der verringerten Zellzahl werden auch Marker für Zellteilung und Stoffwechsel, wie MKI67, GLUT4 und CD36, deutlich reduziert.
Das spricht für eine nachhaltige Hemmung der Krebszellaktivität durch metabolische Konkurrenz der Adipozyten. Tierexperimentelle Modelle bestätigen diese Befunde eindrucksvoll. In Immun-defizienten Mäusen, die mit menschlichen Krebszellen xenotransplantiert wurden, führte die gleichzeitige Implantation der modifizierten Adipozyten zu einer Halbierung der Tumorgröße. Bemerkenswert ist, dass die Tumore nicht nur kleiner waren, sondern auch niedrigere Werte für Hypoxie und Angiogenese aufwiesen, zwei wichtige Faktoren, die das Tumorwachstum und die Metastasierung fördern. Die Wirksamkeit wurde zudem in genetisch modifizierten Mäusen mit Brust- und Pankreaskarzinomen demonstriert, was auf die breitere Anwendbarkeit des Ansatzes hindeutet.
Ursache für diese Hemmung ist eine erweiterte Ressourcennutzung durch die implantierten Fettzellen, wonach weniger energiereiche Substrate im Tumormilieu verfügbar sind. Tumorzellen zeigen in Anwesenheit der modifizierten Adipozyten einen verminderten Glukose- und Fettsäureverbrauch, was sie metabolisch schwächt und das Tumorwachstum einschränkt. Gleichzeitig verbessern die implantierten Adipozyten die systemische Glukosetoleranz und Insulinsensitivität der Tiere, was auf eine positive Wechselwirkung zwischen Stoffwechselkontrolle und Tumorbekämpfung hinweist. Interessanterweise lässt sich der Effekt durch eine erhöhte Zufuhr von Nährstoffen wie Fett oder Zucker teilweise aufheben, was die Rolle der Nährstoffkonkurrenz unterstreicht. Neben der zielgerichteten Aktivierung von UCP1 ist es gelungen, auch andere Metabolismuswege anzugreifen.
So wurde durch die Hochregulierung des Enzyms Uridine-Phosphorylase-1 (UPP1) in Adipozyten erfolgreich der Uridinstoffwechsel eines uridindependenten Pankreaskarzinoms gestört, was zu einer vergleichbaren Tumorhemmung führte. Diese Anpassungsfähigkeit zeigt, dass der AMT-Ansatz individualisiert und auf spezifische metabolische Besonderheiten verschiedener Tumorarten abgestimmt werden kann. Für die klinische Anwendung besonders relevant ist der Einsatz von AAV-basierten CRISPRa-Systemen (CRISPR-Aktivatoren), die eine sichere und effiziente Genaktivierung in den adiposen Zellen gewährleisten. Darüber hinaus wurden induzierbare Systeme entwickelt, bei denen die Genaktivierung mittels Doxycyclin gesteuert werden kann. Damit lässt sich die therapeutische Intervention zeitlich kontrollieren und gegebenenfalls anpassen.
Auch innovative Technologien wie die Verwendung von Mikrowellenscaffolds aus Polycaprolacton (PCL) wurden eingesetzt, die als Implantatträger dienen und die Integration der Adipozyten in das Gewebe erleichtern. Diese Konstrukte sind biokompatibel und können minimal invasiv eingesetzt sowie bei Bedarf entfernt oder ausgetauscht werden. Die Arbeit zeigt zudem, dass Adipozyten aus operativen menschlichen Brustgewebsentnahmen sich gezielt modifizieren lassen. Diese autologen Zellen können ex vivo gentechnisch behandelt und anschließend wieder implantiert werden. So können Patientinnen beispielsweise während rekonstruktiver Brustoperationen von der AMT profitieren.
Neben der Behandlung von invasiven Tumoren gibt es vielversprechende Hinweise darauf, dass AMT auch präventiv wirken kann, etwa in Brustgewebe von Hochrisikopatientinnen mit BRCA1/2-Mutationen. Dort hemmen modifizierte Fettzellen das Wachstum von präkanzerösen Zellorganen und könnten so zur Früherkennung und Prävention beitragen. Die Implikationen dieser Forschung sind weitreichend. Adipozyten sind nicht nur leicht verfügbar und durch etablierte Verfahren wie Liposuktion gewinnbar, sondern sie besitzen aufgrund ihrer metabolischen Kapazität auch einzigartige Eigenschaften, die therapeutisch genutzt werden können. Das AMT-Verfahren könnte schnell in den klinischen Kontext übertragen werden, da es bestehende chirurgische Techniken ergänzt und gleichzeitig auf zellbiologischen Innovationen basiert.
Kritisch zu beachten ist die potenzielle Gefahr einer Kachexie, also eines krankhaften Gewichtsverlustes, welche mit einer Überaktivierung von braunem Fett einhergehen könnte. Allerdings erlauben die entwickelten induzierbaren Systeme und herausnehmbaren Implantate eine Kontrolle und Umkehrbarkeit der Behandlung, was das Sicherheitsprofil deutlich verbessert. Zukünftige Forschung wird darauf abzielen, die exakten molekularen Mechanismen weiter aufzuklären und die AMT-Technologie auch auf weitere Tumorarten und metabolische Wege zu adaptieren. Ebenso wird die Kombination von AMT mit etablierten Therapien wie Chemotherapie, Immuntherapie oder Strahlentherapie erprobt werden, um synergistische Effekte zu erzielen. Insgesamt steht die Implantation gentechnisch modifizierter Adipozyten als innovative, zielgerichtete und personalisierte Strategie im Kampf gegen Krebs exemplarisch für die Fortschritte in der modernen Zelltherapie.
Sie eröffnet neue Perspektiven für Therapien, die den Tumor nicht nur direkt angreifen, sondern auch seinen Energiehaushalt systematisch unterminieren. Die Verbindung von Stoffwechselbiologie, Genom-Engineering und regenerativer Medizin macht AMT zu einem vielversprechenden Hoffnungsträger für die Krebstherapie der Zukunft.