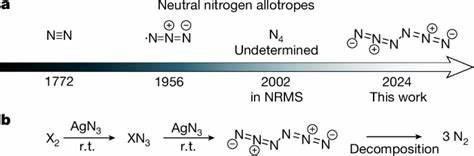
Stickstoff ist eines der am häufigsten vorkommenden Elemente auf der Erde und bildet als molekulares N2 den Hauptbestandteil der Erdatmosphäre. Trotz der Chemievielfalt von Stickstoffverbindungen ist die Existenz neutraler molekularer Stickstoffallotrope jenseits von N2 bisher nahezu unerforscht und galt als eine Herausforderung aufgrund ihrer extremen Instabilität. Die jüngste Entwicklung in der Chemie hat dies nun grundlegend verändert: Die erfolgreiche Vorbereitung von Hexanitrogen mit der Symmetrie C2h, kurz N6, markiert einen Meilenstein in der Darstellung neutraler Stickstoffmoleküle jenseits des einfachen N2-Moleküls. Diese Entdeckung, veröffentlicht 2025 in der renommierten Zeitschrift Nature, öffnet Türen für neue Hochenergie-Materialien und erweitert das fundamentale Verständnis der Stickstoffchemie. Neutrale Polenitrogene - eine wissenschaftliche Herausforderung Lange Zeit galt es als nahezu unmöglich, größere neutrale Stickstoffmoleküle stabil darzustellen.
Die bekannten Stickstoffformen reichen von der einfachen molekularen Form N2 bis hin zu geladenen Polynitrogen-Verbindungen, die allerdings durch ihre Ladungen stabilisiert werden. Abgesehen von N2 wurden nur radikalische und geladenen Spezies wie das Azid-Radikal (•N3) oder pentanitrogenhaltige Salze beobachtet. Neutralen molekularen Allotropen mit höheren Nukleonenzahlen schrieb man entweder nur sehr kurze Lebensdauer zu oder sie blieben rein theoretischer Natur. Der hohe Energiegehalt von polynitrogenen Molekülen macht sie zu attraktiven Kandidaten für Energiespeicherung und Sprengstoffe der Zukunft. Die Energie, die bei der Zersetzung solcher Moleküle in elementaren Stickstoff freigesetzt wird, übertrifft die von herkömmlichen Materialien wie Wasserstoff, Ammoniak oder Hydrazin deutlich.
Zusätzlich erfolgt bei der Zersetzung eine umweltfreundliche Freisetzung ausschließlich von Stickstoffgas, wodurch keine toxischen oder klimaschädlichen Nebenprodukte entstehen. Synthese und Stabilität von Hexanitrogen C2h-N6 Die wegweisenden Experimente zur Synthese von N6 nutzen die Gasphasenreaktion von Halogenen, genauer Chlor oder Brom, mit festem Silberazid (AgN3). Diese Reaktion findet unter vermindertem Druck bei Raumtemperatur statt, gefolgt von einer schnellen Abkühlung und Einbettung der Reaktionsprodukte in argonmatrixe bei etwa 10 Kelvin. Dieses Verfahren der Matrixisolierung erlaubt es, hochreaktive Zwischenprodukte einzufangen und spektroskopisch zu untersuchen, ohne dass diese sofort zerfallen. Die Spektralanalyse, insbesondere mittels Infrarot- und UV-Vis-Spektroskopie, sowie isotopenmarkierte Stickstoffexperimente mit ^15N bestätigten die Präsenz von N6-Molekülen in der Argonmatrix.
Auffällige Banden im Infrarot-Spektrum, die nicht mit den Ausgangsstoffen oder bekannten Nebenprodukten erklärbar waren, korrespondierten mit berechneten Schwingungsmoden von N6. Darüber hinaus zeigte das UV-Vis-Spektrum charakteristische elektronische Übergänge, die mit theoretischen Vorhersagen zu N6 übereinstimmen. Dies untermauerte die Tatsache, dass tatsächlich eine neue neutrale Stickstoffallotrop-Form synthetisiert wurde. Von besonderer Bedeutung ist, dass N6 auch in reinem Zustand als dünner Film bei flüssigem Stickstoff-Temperatur (77 Kelvin) gehalten und untersucht werden konnte. Dies zeigte eine vergleichbare Stabilität wie die in Matrices isolierte Form, was darauf hindeutet, dass N6 nicht nur eine kurzlebige Reaktionszwischenstufe, sondern ein metastabiles Molekül mit relevanter Lebensdauer ist.
Theoretische Einsichten und Bindungsverhältnisse Ab initio Rechnungen auf hohem Niveau, darunter solche mit der CCSD(T)/cc-pVTZ Methode, halfen, die Struktur, Bindungsverhältnisse und energetische Profile von N6 zu verstehen. Die bevorzugte Konformation besitzt C2h Symmetrie und zeigt zwei aneinandergekoppelte N3 Einheiten, die durch eine zentrale Einfachbindung verbunden sind. Die Bindungslängen und Elektronendichteverteilungen deuten auf eine delokalisierte Bindungssituation hin, die für die ungewöhnliche Stabilität verantwortlich ist. Die höchsten Bindungsordnungen finden sich an den äußeren Stickstoffpaaren, während die zentrale Bindung eine geringere Bindungsstärke aufweist. Die Berechnungen ergaben eine signifikante Hürde für die Zerlegung in drei N2-Moleküle von etwa 14,8 kcal/mol, was eine begrenzte kinetische Stabilität garantiert.
Elektronendichteanalysen wie die Untersuchung des Laplacian und der Elektronendichte-Lokalisationsfunktion (ELF) bestätigten, dass die Schwachstellen in der zentralen Bindung liegen. Interessanterweise ist die alternative Zerlegung in zwei Azidradikale (•N3) endergonisch und wird daher nicht bevorzugt verfolgt, was der thermodynamischen Stabilität von N6 zugutekommt. Bedeutung für Hochenergie-Materialien und Umweltverträglichkeit Die hohe gespeicherte Energie in N6 macht es zu einem vielversprechenden Kandidaten für neuartige energetische Materialien. Die thermodynamische Berechnung der Zersetzungsenthalpie ergab Werte, die deutlich über denen von TNT und anderen bekannten Sprengstoffen wie HMX liegen. Die Dichte der hypothetischen Kristallform von N6 wurde mit etwa 1,51 g/cm³ abgeschätzt, was in Kombination mit der hohen Reaktionsenthalpie ausgezeichnete Detonationsparameter erwarten lässt.
Ein weiterer entscheidender Vorteil von N6 besteht darin, dass seine Zersetzung ausschließlich in harmloses Stickstoffgas erfolgt. Das schafft die Basis für umweltfreundliche Energiespeicher und Treibstoffe, die ohne die üblichen Schadstoffe oder Treibhausgase operieren. Herausforderungen und Sicherheitsaspekte Die Herstellung von N6 beruht auf hochreaktiven und potenziell explosiven Edukten wie Silberazid und Halogenaziden. Dies erfordert strenge Sicherheitsvorkehrungen im Labor, einschließlich Schutzkleidung, Dosierung in kleinsten Mengen und Abstand zu Zündquellen. Eine weitere Herausforderung stellt die Handhabung und stabile Speicherung von N6 dar, da es nur unter kryogenen Bedingungen dauerhaft erhalten bleiben kann.
Dennoch zeigt das Forschungsprojekt, dass mit geeigneten Methoden und Kenntnissen neutrale Stickstoffallotrope zugänglich sind. Zukunftsaussichten und wissenschaftliche Bedeutung Die Darstellung von N6 als neutralem Stickstoffallotrop widerlegt das lange gehegte Vorurteil, dass höhere neutrale Polynitrogene kaum isolierbar seien. Diese Errungenschaft stimuliert erneute Forschung in einem bisher vernachlässigten Bereich der Chemie mit großem Potenzial. Mögliche Weiterentwicklungen könnten die Stabilisierung von N6 bei höheren Temperaturen oder eine Integration in Materialien mit praktischen Anwendungen umfassen. Die Verbindung von experimentellen Techniken wie Matrixisolierung mit hochpräzisen Computermethoden wird dabei essenziell sein.