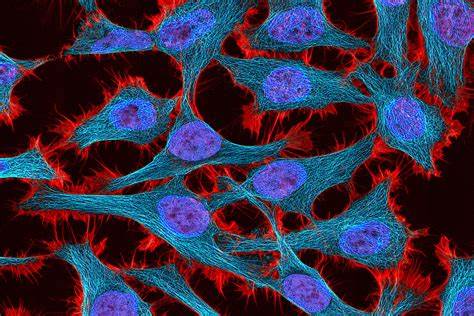
Die Gentherapie steht heute an der Schwelle zu bahnbrechenden Fortschritten, die die Behandlung zahlreicher bisher unheilbarer Krankheiten revolutionieren könnten. Einer der entscheidenden Faktoren für den Erfolg dieser Therapien ist die präzise Steuerung der Expression therapeutischer Gene. Überschießende oder unzureichende Expression von Transgenen kann nicht nur die Wirksamkeit beeinträchtigen, sondern auch unerwünschte Nebenwirkungen auslösen. Forscher des Massachusetts Institute of Technology (MIT) haben nun neue genetische Schaltkreise entwickelt, die eine wesentlich genauere Regulierung der Transgenexpression in verschiedensten Zelltypen ermöglichen und so die Gentherapie sicherer und zielgerichteter machen. Der Kern dieser Innovation ist ein genetisches Kontrollsystem namens ComMAND, ein kompaktes, mikroRNA-basiertes Incoherent Feedforward Loop (iFFL), welches auf einem einzigen Transkript kodiert wird.
Die Besonderheit dieses Designs besteht darin, dass mikroRNA-Elemente in einem Intronic-Bereich des therapeutischen Gens integriert sind. Diese mikroRNAs regulieren nachgeschaltet die mRNA des eigentlichen Therapiegens und gewährleisten so eine dichte Kopplung zwischen der Produktion des regulatorischen Elements und des Therapeutikums. Traditionell gestaltet sich die Dosiskontrolle bei der Gentherapie als äußerst komplex. Variabilität in der Anzahl der ins Genom integrierten Genkopien, sogenannte Kopiezahlvariationen, sowie Unterschiede in der genomischen Lage der Integration führen häufig zu stark schwankenden Expressionsniveaus zwischen einzelnen Zellen. Diese Heterogenität kann reale therapeutische Auswirkungen zeigen.
Für viele monogenetische Erkrankungen, bei denen ein fehlendes oder defektes Gen für Krankheitssymptome verantwortlich ist, bildet die richtige Dosierung der therapeutischen Kopien eines Gens eine kritische Herausforderung. Beispielsweise kann eine Überexpression bestimmter Proteine zu schwerwiegenden Nebenwirkungen wie kardialen Problemen oder neurologischen Störungen führen. Andererseits ist eine zu geringe Expression ineffektiv und bietet keinen therapeutischen Nutzen. Die sogenannte „Goldilocks“-Zone der Gentherapie – nicht zu viel und nicht zu wenig – ist somit essenziell. ComMAND reagiert genau auf diese Herausforderungen, indem es auf posttranskriptionaler Ebene durch mikroRNA-Medikation die Expression stabilisiert.
Im Gegensatz zu herkömmlichen Systemen, die oft aus mehreren unabhängigen Genkontrakten bestehen, integriert ComMAND regulatorische Elemente direkt intronisch in denselben Transkript wie das therapeutische Gen. Dies führt zu einer engmaschigen Kontrolle, da beide Komponenten – der Regulator und das Wirkgen – synchron produziert werden. Das Resultat ist eine signifikante Reduktion der Zell-zu-Zell-Variabilität in der Genexpression. Das System nutzt mikroRNAs, kleine nicht-kodierende RNA-Moleküle, die Ziel-mRNAs auf der posttranskriptionalen Ebene erkennen und deren Translation hemmen oder den Abbau fördern. Die im ComMAND-Schaltkreis verwendeten mikroRNAs sind synthetisch konzipiert und orthogonal zum menschlichen Genom.
Dadurch wird sichergestellt, dass keine unbeabsichtigte Beeinflussung endogener Gene stattfindet, was die Sicherheit des Systems weiter erhöht. Eine Schlüsselinnovation von ComMAND ist die Verwendung eines einzigen Transkripts mit einem intronischen mikroRNA-Element, das über die sogenannte Inkohärente Feedforward-Schleife (iFFL) das Ausgangsprotein reguliert. Dieses System sorgt nicht nur für eine stabile mittlere Expressionsstärke, sondern verringert auch die Variabilität zwischen einzelnen Zellen, was bei therapeutischen Anwendungen von außerordentlicher Bedeutung ist. Die Forscher am MIT führten umfangreiche experimentelle Untersuchungen an verschiedenen Zelltypen durch, darunter primäre menschliche T-Zellen, Rattenneurone, Maus-embryonale Fibroblasten und humaninduzierte pluripotente Stammzellen (iPSCs). In all diesen relevanten Kontexten bestätigte sich die Fähigkeit von ComMAND, die Breite der Expressionsniveaus signifikant zu reduzieren und den Output der Therapeutika innerhalb therapeutisch sicherer Grenzen zu halten.
Darüber hinaus wurde die Funktionsfähigkeit von ComMAND in verschiedenen Genlieferverfahren validiert. Sowohl in der klassischen Transfektion von DNA-Plasmiden als auch bei der lentiviralen Transduktion und der PiggyBac-Transposase-Integration zeigte das System beständige und konsistente Ergebnisse. Die Kompaktheit des Designs ist hierbei von besonderem Vorteil, da sie die Hürden bei der Verpackung und Lieferung von Gentherapie-Vektoren, die oft durch begrenzte Kapazitäten limitiert sind, deutlich senkt. Die Forschungsarbeit hob zudem hervor, dass ComMAND auf Schlüsselparameter eingestellt werden kann, um die Expression fein abzustimmen. Beispielsweise erlauben Variationen im Promoter, der das Transkript steuert, oder Modifikationen der mikroRNA-Sequenz und des Scaffolds, die das Processing beeinflussen, eine praktische Anpassung der Expressionsstärken.
Allerdings fanden die Wissenschaftler heraus, dass manche Methoden, wie die Erhöhung der Anzahl der mikroRNA-Bindungsstellen, nur begrenzte Auswirkungen auf die Regulation im ComMAND-System haben. Dies hängt mit den mechanistischen Besonderheiten der mikroRNA-vermittelten Regulation und der optimalen Kopplung im Single-Transcript-Design zusammen. Die theoretische Modellierung des Systems untermauert die experimentellen Ergebnisse und zeigt, dass physiologische Grenzen, insbesondere die Sättigung des RNA-induced silencing complex (RISC), die Grenzen der Dosiskontrolle definieren. Solange die Belastung des RISC-Systems innerhalb bestimmter Grenzen bleibt – was bei niedrigeren DNA- oder Vektor-Kopienzahlen therapeutisch günstiger ist – bietet ComMAND robuste Anpassungen für transgene Expressionsprofile. Darüber hinaus hat ComMAND eine eingebaute „Fail-safe“-Funktion: Gelingt die korrekte Spleißung des Transkripts nicht, so kann das therapeutische Protein nicht übersetzt werden.
Auf diese Weise wird das Risiko einer Fehlregulation und damit möglicher Toxizität minimiert, was die Sicherheit des Systems weiter erhöht. Ein beeindruckendes Anwendungsbeispiel für die Technologie ist die Regulierung von Genen, die bei monogenetischen neurologischen Erkrankungen relevant sind, wie etwa das FXN-Gen bei Friedrichs Ataxie und das Fmr1-Gen beim Fragilen X-Syndrom. Beide Erkrankungen zeichnen sich durch eine empfindliche Balance bei der Genexpression aus, bei der sowohl Unter- als auch Überexpression unerwünschte Effekte verursachen können. ComMAND erlaubt es, die Expression dieser therapeutisch bedeutsamen Gene innerhalb eines engen und sicheren Bereichs zu steuern, was den Weg für zukünftige Therapien ebnet. Die präzise Dosierung durch ComMAND ist gerade in klinischer Hinsicht von größter Bedeutung, denn eine zu hohe Dosierung kann toxische Phänotypen hervorbringen, während eine zu geringe Wirkungslosigkeit liefert.
Die Fähigkeit, systematische Schwankungen der Gentherapie-Dosis in einzelnen Zellen auszugleichen, verbessert nicht nur die Wirksamkeit, sondern auch die Verträglichkeit der Behandlung. Auch wenn ComMAND fortgeschrittene Kontrollen auf posttranskriptionaler Ebene liefert, gibt es weitere regulatorische Ebenen in der Genexpression, etwa auf translationaler oder posttranslationaler Stufe, die in zukünftigen Entwicklungen mit einbezogen werden könnten, um eine noch umfassendere Kontrolle zu gewährleisten. Darüber hinaus eröffnet die Modularität des Designs die Möglichkeit, verschiedene Promoter- oder Regulatoren einzusetzen, um gezielt auf zelltyp- oder zustandsspezifische Bedingungen zu reagieren. Dies könnte helfen, die Gentherapie noch differenzierter und sicherer zu gestalten. So könnte beispielsweise eine zusätzliche Regulation durch zellzustandsabhängige Elemente erreicht werden, die ComMAND die Eignung als Teil komplexerer genetischer Therapeutika verleiht.
Die Entwicklung von ComMAND ist ein Meilenstein in der Gentherapieforschung. Die Kombination aus kompaktem Design, präziser Dosiskontrolle, vielseitiger Anwendbarkeit und eingebauter Sicherheit schafft neue Möglichkeiten für die Behandlung von genetischen Erkrankungen mit einem bisher nicht möglichen Maß an Kontrolle und Vorhersagbarkeit. Abschließend lässt sich festhalten, dass die Arbeit am MIT nicht nur grundlagenwissenschaftlich einen erheblichen Schritt nach vorn bedeutet, sondern auch weitreichende klinische Anwendungen verspricht. Die Integration von mikroRNA-basierten Regulationsmechanismen in therapeutische Gene könnte zukünftig dazu beitragen, Gentherapien effektiver und verträglicher zu machen und so vielen Patientinnen und Patienten zu helfen, deren Krankheiten bislang als unheilbar galten.