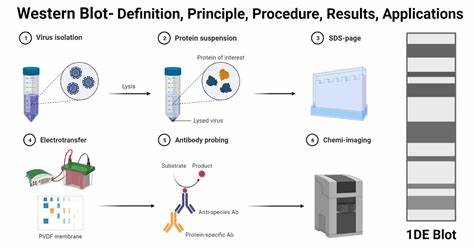
Der Western Blot hat sich als unverzichtbare Methode in der molekularbiologischen und biochemischen Forschung etabliert, um spezifische Proteine in komplexen Proben nachzuweisen und deren Expressionslevel zu analysieren. Durch die Kombination aus elektrolytischer Trennung der Proteine mittels SDS-PAGE und der hochselektiven Bindung durch spezifische Antikörper erlaubt das Verfahren nicht nur die Bestimmung der Proteinpräsenz, sondern auch eine genaue Einschätzung von Größe, Menge und Modifikationen des Zielmoleküls. Vertrautheit mit den Grundlagen und eine akribische Ausführung jedes Schrittes sind essentiell, um reproduzierbare und qualitativ hochwertige Ergebnisse zu erzielen. Die vorliegende Übersicht erklärt die wesentlichen Prinzipien des Western Blot sowie eine Schritt-für-Schritt Anleitung, die von der Probenvorbereitung bis hin zur Detektion und Analyse reicht. Den Beginn macht die Probenvorbereitung, die das Zelllyseverfahren einschließt, bei dem die Proteine aus Zellkomponenten extrahiert werden.
Hierbei spielen die Wahl des Lysepuffers sowie das Hinzufügen von Protease- und Phosphataseinhibitoren eine entscheidende Rolle, um den natürlichen Zustand der Proteine bestmöglich zu bewahren und Proteindegradation zu verhindern. Anschließend folgt die Quantifizierung der Gesamtproteinmenge, welche essenziell ist, um gleiche Proteinkonzentrationen in den jeweiligen Proben für eine direkte Vergleichbarkeit zu gewährleisten. Methoden wie der Bradford- oder BCA-Test sind hierbei weit verbreitet und bieten zuverlässige Messergebnisse. Im nächsten Schritt werden die Proteine mittels SDS-PAGE getrennt. Die Denaturierung der Proben erfolgt durch Zugabe von SDS und einem Reduktionsmittel, das Disulfidbrücken aufbricht, sodass die Proteine linearisiert und mit einer einheitlichen negativen Ladung versehen werden.
Dadurch wandern sie abhängig von ihrer Molekülmasse durch das Gel, wobei kleinere Proteine schneller durch die Gelmatrix laufen. Nach erfolgter Auftrennung müssen die Proteine auf eine stabile Membran, typischerweise Nitrocellulose oder PVDF, übertragen werden, um darauf die spezifische Antikörperbindung zu ermöglichen. Für die Proteinübertragung existieren zwei gängige Methoden: der klassische Feuchttransfer und der halb-trockene Transfer. Der Feuchttransfer ist bekannt für seine hohe Effizienz bei einer Vielzahl von Proteinmolekülgrößen und findet in einem mit Pufferlösung gefüllten Tank statt. Trotz des höheren Zeitbedarfs und des Verbrauchs größerer Puffermengen bietet er zuverlässige Ergebnisse, die besonders bei Proteinen mit höherem Molekulargewicht von Vorteil sind.
Der halb-trockene Transfer zeichnet sich durch eine kürzere Transferzeit und geringeren Pufferverbrauch aus, indem die Membran-Gel-Sandwich-Konstellation zwischen zwei Elektrodenplatten gelegt wird. Während diese Methode schneller und praktischer ist, kann sie bei sehr großen Proteinen weniger effektiv sein und erfordert sorgfältige Kontrolle, um ein Austrocknen der Filterpapiere zu vermeiden. Sobald die Proteine auf der Membran fixiert sind, erfolgt das Blockieren der Membranoberfläche. Dieser Schritt ist notwendig, um unspezifische Bindungen der Antikörper an die Membran zu verhindern, die sonst zu einem erhöhten Hintergrundrauschen führen würden. Typische Blockierungslösungen enthalten entweder Bovine Serumalbumin oder fettfreie Milch in Waschpuffern wie TBST oder PBST.
Im Anschluss wird die Membran mit dem primären Antikörper inkubiert, der spezifisch an das gewünschte Protein bindet. Die Inkubation kann einige Stunden bei Raumtemperatur oder über Nacht bei vier Grad Celsius stattfinden, begleitet von sanftem Schütteln um eine gleichmäßige Durchdringung zu garantieren. Nach der Entfernung nicht gebundener Antikörper erfolgt eine Reihe von Waschschritten, die unerwünschte Hintergrundsignale minimieren. Danach kommt die Sekundärantikörper-Inkubation, bei der der Sekundärantikörper die Spezies des primären Antikörpers erkennt und an diesen bindet. Der Sekundärantikörper ist meist mit einem Enzym wie Horseradish Peroxidase (HRP) oder einem Fluorophor konjugiert, was die spätere Detektion des Signals ermöglicht.
Auch hier werden erneut Waschschritte durchgeführt, um überschüssige, ungebundene Antikörper zu entfernen. Für die Signaldetektion stehen mehrere Methoden zur Verfügung, die je nach Sensitivitätsbedarf und vorhandener Ausstattung gewählt werden. Die chemilumineszente Detektion beruht auf der enzymatischen Umwandlung eines Substrats durch HRP, wodurch Licht erzeugt wird. Dieses wird von Kamerasystemen oder auf Röntgenfilmen registriert. Die Methode zeichnet sich durch eine hohe Empfindlichkeit und gute Quantifizierbarkeit aus, erfordert jedoch spezielle Reagenzien und Geräte.
Die fluoreszierende Detektion bietet den Vorteil einer stabilen Signalspeicherung und eine erweiterte dynamische Bandbreite, was besonders bei der quantitativen Analyse und Multiplexing-Anwendungen vorteilhaft ist. Die Membranen können separat aufbewahrt und mehrfach abgebildet werden. Allerdings ist die Ausstattung für Fluoreszenzmessungen kostenintensiver. Schließlich gibt es die kolorimetrische Detektion, bei der das Enzym ein chromogenes Substrat umsetzt, das sichtbar gefärbte Banden erzeugt. Diese Methode ist weniger empfindlich, aber durch den einfachen Umgang und die Möglichkeit der visuellen Auswertung ohne teure Geräte weiterhin verbreitet.
Abschließend erfolgt die Analyse der Ergebnisse. Die Identifikation des Proteinbandes erfolgt anhand seiner erwarteten Molekülmasse, während die Intensität der Bande als Indikator für die Proteinmenge dient. Die Ergebnisse werden typischerweise halb-quantitativ durch Densitometrie ausgewertet, wobei Softwarelösungen helfen, die Signalstärken vergleichend darzustellen. Essentiell ist hierbei auch die Verwendung von Kontrollexperimenten, darunter Lade- und Expressionskontrollen, die als interne Referenzpunkte dienen. Nur durch sorgfältige Validierung der Antikörper, Optimierung der Protokollparameter und strikte Einhaltung der Ablaufschritte kann der Western Blot seine volle Aussagekraft entfalten.
Typische Herausforderungen wie unspezifische Signale, schwache Banden oder schlechte Übertragungseffizienz lassen sich durch gezielte Problemanalyse beheben. Der Western Blot bleibt damit eine vielseitige und leistungsfähige Methode für die Proteinanalyse, die mit ihrem hohen Informationsgehalt und der Anpassbarkeit an diverse Fragestellungen Forschern weltweit unverzichtbare Dienste leistet.







![Raycast for Hyperactive AI Obsessives [video]](/images/33F868C2-DD27-4489-8A66-51E325338222)