Die Zersetzung von Cellulose, dem weltweit häufigsten biogenen Polymer, stellt eine der größten Herausforderungen in der biologischen Umwandlung von pflanzlicher Biomasse dar. Trotz ihrer einfachen chemischen Struktur als ein Polysaccharid aus Glucoseeinheiten weist Cellulose aufgrund ihrer kristallinen und mikrofasrigen Organisation sowie der engen Verflechtung mit Lignin und Hemicellulosen in der Pflanzenzellwand eine bemerkenswerte Resistenz gegenüber enzymatischem Abbau auf. So ist die effiziente Auflösung von Cellulose von herausragender Bedeutung für die Gewinnung von Biokraftstoffen, Chemikalien und anderen Wertstoffen aus nachwachsenden Rohstoffen und somit ein Grundpfeiler einer nachhaltigen, bio-basierten Wirtschaftsentwicklung. In jüngster Zeit konnten Wissenschaftler ein bislang unbekanntes Enzym aus einer sogenannten metagenomischen Ressource entdecken, das eine völlig neue oxidative Spaltung von Cellulose katalysiert. Dieses Enzym entstammt dem genetischen „Dark Matter“ – jenem Bereich von DNA-Sequenzen in mikrobiellen Gemeinschaften, deren Funktion bislang nicht bekannt oder klassifiziert ist.
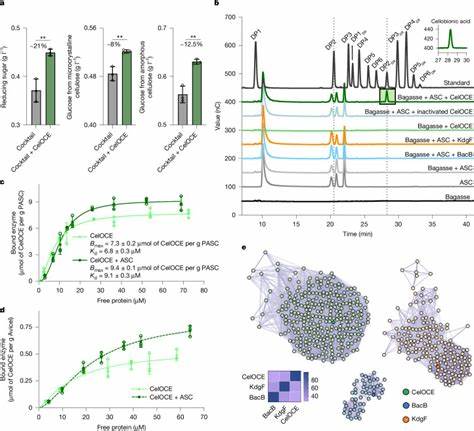
Die Entdeckung wurde durch die Analyse mikrobieller Gemeinschaften aus einem seit Jahrzehnten mit Zuckerrohr-Bagasse bedeckten Boden in Brasilien ermöglicht, wo sich spezialisierte Mikroben zur Abbau dieser komplexen Biomasse angesiedelt haben. Das gefundene Enzym, als CelOCE (Cellulose Oxidative Cleaving Enzyme) bezeichnet, zeichnet sich durch eine bemerkenswerte Fähigkeit aus, Cellulose exo-typisch und regioselektiv am C1-Atom zu oxidieren. Dabei entsteht ausschließlich Cellobionsäure, was für eine präzise und kontrollierte biochemische Aktion spricht. Dieses Verhalten unterscheidet CelOCE fundamental von den bislang bekannten Enzymen im Bereich des Celluloseabbaus, insbesondere von LPMOs (lytic polysaccharide monooxygenases), die klinische und biotechnologische Relevanz besitzen, jedoch in Struktur und Wirkmechanismus verschieden sind. Strukturell entfaltet CelOCE eine kompakte jelly-roll-Faltung, die ein mononukleares Kupferzentrum beherbergt, welches tief in einem taschenartigen aktiven Zentrum verborgen ist.
Auffallend ist seine homodimere Konfiguration: Jedes der beiden Untereinheiten trägt ein aktives Kupferzentrum. Diese Anordnung ermöglicht es einer Untereinheit, an der Zellulose zu binden und das Substrat zu oxidieren, während die andere Untereinheit gleichzeitig Wasserstoffperoxid vor Ort erzeugt. Letzteres dient als Co-Substrat und treibt die peroxygenase-ähnliche Katalyse an, wobei ein cleverer Mechanismus zur Selbstversorgung mit diesem reaktiven Sauerstoffspezies etabliert ist. Vergleichende biochemische Untersuchungen zeigten, dass CelOCE unter aeroben sowie anaeroben Bedingungen in Anwesenheit von exogen zugeführtem Wasserstoffperoxid aktiv ist, was seine Flexibilität und Effizienz unter unterschiedlichen Umweltbedingungen unterstreicht. Ein weiterer wichtiger Befund ist die Bindungsaffinität des Enzyms zu Cellulose.
CelOCE weist eine spezifische und stabile Wechselwirkung mit kristalliner und amorpher Cellulose auf, ohne dabei andere Polysaccharide wie Chitin oder Hemicellulosen zu degradieren. Die Bindung erfolgt über eine abgeflachte Oberfläche, die in unmittelbarer Nähe zum Kupferzentrum liegt, und wird durch konservierte Aminosäurereste wie Phenylalanin und Glutamin moduliert. Mutationen an Schlüsselstellen führen zu einem drastischen Aktivitätsverlust, was die Bedeutung dieser Interaktionsstellen unterstreicht. Die mikrobielle Herkunft dieses Enzyms ist ebenso bemerkenswert. Es wurde einem bisher weitgehend unbekannten bakteriellen Stamm zugeordnet, der in der Umwandlung pflanzlicher Biomasse spezialisiert ist und dessen enzymatisches Repertoire vielfältige Glycosylhydrolasen umfasst.
Dies zeigt, wie viel unerschlossenes Potenzial in der sogenannten mikrobiellen „Dunkelmaterie“ verborgen ist und wie moderne metagenomische Ansätze neue biotechnologisch relevante Enzyme hervorbringen können. Aus technischer Sicht ist die Integration von CelOCE in gentechnisch modifizierte Stämme des filamentösen Pilzes Trichoderma reesei gelungen, einem bewährten Industriestamm für die cellulolytische Enzymproduktion. Expression und Sekretion dieses Enzyms führten zu einer signifikanten Steigerung der Glucosefreisetzung aus vorbehandelter Zuckerrohrbagasse und Eukalyptus-Biomasse bei realitätsnahen industriellen Bedingungen. Interessanterweise übertraf die Kombination des CelOCE-haltigen Enzymcocktails sogar die Effizienz einer im gleichen System produzierten AA9 LPMO, was die besondere Wirkung des neu entdeckten Enzyms unterstreicht. Die Vermutung liegt nahe, dass die exo-aktive Oxidationsweise in Kombination mit der in situ Wasserstoffperoxiderzeugung einen synergistischen Vorteil bringt.
Diese Entdeckung hat weitreichende Implikationen: Sie erweitert das bisher bekannte Spektrum an Mechanismen, mit denen Mikroorganismen Biomasse abbauen, und stellt eine neue Klasse von Kupfer-basierten Oxidoreduktasen vor. Die Tatsache, dass CelOCE nur aus 115 Aminosäuren besteht, macht es zu einem der kleinsten bekannten katalytisch aktiven Proteine in diesem Bereich, was attraktive Möglichkeiten für proteinchemische Modifikationen und biotechnologische Anwendungen eröffnet. Darüber hinaus trägt das bessere Verständnis der enzymatischen Umwandlung von Cellulose und deren molekularen Grundlagen zur nachhaltigen Nutzung pflanzlicher Reststoffe bei. Die Umwandlung agroindustrieller Nebenprodukte in wertvolle Bioprodukte und erneuerbare Energieträger ist ein zentraler Bestandteil der globalen Bemühungen um eine klimafreundliche Bioökonomie. Die innovative Methode der Metagenomsuche und die multidisziplinäre Herangehensweise, die neben bioinformatischen Analysen Techniken wie Kristallstrukturanalyse, EPR-Spektroskopie und Bioreaktorexperimente umfassen, sind ein Musterbeispiel für modernen biowissenschaftlichen Forschungsanspruch.
Sie zeigen, wie die Erschließung bisher unzugänglicher mikrobieller Ressourcen entscheidende Fortschritte in der Enzymologie und Biotechnologie ermöglichen kann. Insgesamt markiert die Identifikation und Charakterisierung von CelOCE einen bedeutenden Schritt in Richtung effizienterer und nachhaltigerer Nutzung von pflanzlicher Biomasse. Die Kombination aus neuartiger aktiver Zentrenstruktur, innovativem Mechanismus der Wasserstoffperoxiderzeugung und exo-aktivem oxidativem Spaltverhalten bietet weitreichende Chancen für die Entwicklung verbesserter enzymatischer Cocktails in industriellen Prozessen. Diese werden zukünftig eine entscheidende Rolle bei der Produktion von Biokraftstoffen und Biochemikalien spielen und zur Weiterentwicklung grüner Technologien beitragen.