Krebs zählt weltweit nach wie vor zu den größten Herausforderungen in der Medizin und ist eine der Hauptursachen für Todesfälle. Besonders schwierig zu behandeln sind Tumorzellen, die eine hohe Metastasierung aufweisen und gegen Standardbehandlungen resistent sind. Untersuchungen haben gezeigt, dass etwa 70 Prozent aller krebsbedingten Todesfälle auf solche metastatischen Krebszellen zurückzuführen sind, die sich der Wirkung der aktuellen Therapien weitgehend entziehen. Diese Erkenntnisse haben Wissenschaftler weltweit dazu motiviert, neue Wege zu suchen, um diese aggressiven Zelltypen gezielt zu eliminieren. Ein bedeutender Durchbruch wurde nun von einem interdisziplinären französischen Forscherteam gemacht, das eine neue Klasse von Molekülen entwickelt hat, die auf bislang unzureichend adressierte Schwachstellen von metastatischen Krebszellen abzielen.
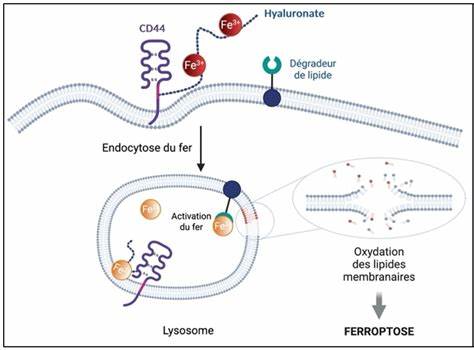
Im Zentrum dieser Forschung steht der Prozess der Ferroptose, ein spezifischer, eisenabhängiger Zelltodmechanismus, der den Abbau der Zellmembranen fördert und dadurch zum Zelltod führt. Das Besondere an diesen Molekülen ist ihre Fähigkeit, die Ferroptose gezielt in Krebszellen mit hohem Metastasierungspotenzial auszulösen. Diese Zellen zeichnen sich durch eine verstärkte Aufnahme von Eisen aus, die vor allem durch die hohe Expression des Oberflächenproteins CD44 bedingt ist. CD44 unterstützt die Invasion und Metastasierung von Tumoren und ermöglicht es den Krebszellen, sich erfolgreich vor herkömmlichen Therapien zu schützen. Durch die Kombination chemischer Innovationen und tiefer biologischer Einblicke konnte ein kleiner Wirkstoff namens Fento-1 (Fentomycin) entwickelt werden.
Fento-1 weist eine beeindruckende Fähigkeit auf, die spezifisch die eisenreichen lysosomalen Kompartimente der Krebszellen anzugreifen und dort eine Kettenreaktion zu entfachen, die letztlich zum Abbau der Zellmembranen führt. Die Moleküle wirken durch zwei Schlüsselfragmente: das erste bindet gezielt an die Plasmamembran, wodurch die Wirkstoffe präzise in die Zellen eingeschleust werden. Das zweite Fragment erhöht die Eisenaktivität innerhalb der Lysosomen, was die Entstehung von reaktiven Sauerstoffspezies fördert. Diese Sauerstoffradikale sind sehr instabil und schädigen in der Folge die Membranen der Krebszellen irreversibel. Die Folge ist eine Kaskade von oxidativem Stress, die die Zellen nicht mehr reparieren können und in den Zelltod – die Ferroptose – getrieben werden.
Während herkömmliche Antikrebsmittel hauptsächlich auf schnell proliferierende Zellen im Primärtumor abzielen, um deren Zellteilung zu stoppen, versagen sie oft darin, die resistenten, stoffwechselanpassungsfähigen Krebszellen mit hoher Metastasierungskraft zu eliminieren. Diese sogenannten „drug-tolerant persister cells“ oder persister Krebszellen sind besonders problematisch, da sie nach der Diagnose häufig die Ursache für Rückfälle sind. In präklinischen Studien, etwa an Tiermodellen für metastasierten Brustkrebs, zeigte die Anwendung von Fento-1 eine signifikante Reduktion des Tumorvolumens. Auch an Patientenbiopsien von Bauchspeicheldrüsenkrebs und Sarkomen konnte eine ausgeprägte zytotoxische Wirkung nachgewiesen werden. Diese Erfolge bedeuten einen potenziellen Paradigmenwechsel in der Krebstherapie: Statt nur auf Zellteilung und Wachstumsprozesse einzuwirken, wird gezielt der Stoffwechsel und die spezifische Schwachstelle in Zellmembran und Eisenstoffwechsel der metastatischen Krebszellen angegriffen.
Die Zusammenarbeit namhafter Forschungseinrichtungen wie Institut Curie, CNRS und Inserm sowie internationaler Partner hat diesen Fortschritt erst ermöglicht. Der Forscher Raphaël Rodriguez und sein Team am Labor für Biomedizin haben hierbei mit innovativer Chemie den entscheidenden Beitrag erbracht. Das Konzept beruht auf der detaillierten Kenntnis der Interaktion zwischen Eisen, lysosomaler Funktion und Membranstruktur der Krebszellen. Die katalytische Rolle des Eisens bei der Bildung von reaktiven Sauerstoffradikalen liefert dabei den Schlüssel, um die Krebszellen selektiv zu zerstören, ohne gesunde Zellen gleichermaßen zu schädigen. Das Augenmerk auf die lysosomalen Eisenvorräte ist ebenso entscheidend, denn diese Organellen sind zentrale Recyclingzentren für Zellmaterial und verwerten unter anderem beschädigte Moleküle.
Die Überlastung mit Eisen verleitet die Krebszellen zu einer Verwundbarkeit gegenüber oxidativen Schäden durch das neue Molekül. Hochauflösende Mikroskopie ermöglichte es den Wissenschaftlern zudem, die Verteilung und Wirkungsweise von Fento-1 in den Krebszellen direkt sichtbar zu machen, was für das Verständnis der Wirkmechanismen enorm wichtig war. Trotz aller Erfolge am präklinischen Modell stößt die Entwicklung dieser Wirkstoffe an die Grenzen vorhandener Kenntnisse in der Krebsbehandlung. Die Abläufe in menschlichen Tumoren sind oft komplexer und variabler als im Labor. Deshalb sind klinische Studien unerlässlich, um die Sicherheit und Wirksamkeit dieser Moleküle für Patientinnen und Patienten zu bestätigen.
Das Potenzial, mit der Aktivierung der Ferroptose eine neue Behandlungslinie zu etablieren, könnte die Prognose für Menschen mit aggressiven und therapieresistenten Krebsarten erheblich verbessern. Dieses innovative Therapiekonzept ergänzt bestehende Chemotherapien und versucht, die Ursachen der Resistenz zu überwinden, anstatt nur Symptome zu lindern. Unterstützt wurde diese wegweisende Forschung von europäischen Förderprogrammen, verschiedenen Stiftungen im Krebsbereich und staatlichen Institutionen, die Forschung im Onkologiebereich fördern. Die multidisziplinäre Zusammenarbeit zeigt, wie wichtig Vernetzung zwischen Chemie, Biologie, Medizin und technischen Disziplinen ist, um komplexe Herausforderungen wie Krebs effektiv anzugehen. Darüber hinaus werfen die Erkenntnisse zur Rolle von Eisen in der Krebsbiologie auch neue Fragen zur Bedeutung von Metallstoffwechselstörungen und deren Einfluss auf Tumorgeschehen auf.
Das Verständnis solcher Zusammenhänge könnte langfristig nicht nur bei der Entwicklung von Therapeutika helfen, sondern auch präventive Strategien beeinflussen. Die Entwicklung der phospholipidabbauenden Moleküle als Werkzeug zur gezielten Aktivierung der Ferroptose markiert einen bedeutenden Schritt in der personalisierten Medizin bei Krebs. Sie unterstreicht die Notwendigkeit, differenzierte Angriffspunkte innerhalb der Krebszelle zu suchen, um deren komplexe Anpassung und Widerstandsfähigkeit zu überwinden. In Zukunft könnten solche Wirkstoffe auch in Kombination mit immuntherapeutischen Ansätzen oder anderen zielgerichteten Therapien eingesetzt werden, um Synergieeffekte zu erzielen und die langfristige Kontrolle der Krankheit zu verbessern. Die Erkenntnisse aus dieser Forschung haben somit das Potenzial, die Krebstherapie nachhaltig zu verändern und Betroffenen neue Chancen auf Heilung oder zumindest eine bessere Lebensqualität zu bieten.
Insgesamt setzt die Entdeckung einer neuen Klasse von Molekülen, die gezielt metastatische, therapieresistente Krebszellen durch die Aktivierung von Ferroptose eliminieren, einen vielversprechenden Meilenstein. Sie eröffnet neue Perspektiven gegen eine der tödlichsten Formen von Krebs und unterstreicht die Bedeutung innovativer Forschungsansätze, die über die klassischen Therapieansätze hinausgehen. Mit einer erfolgreichen Umsetzung in klinischen Studien könnte diese Entwicklung den Weg für moderne, effizientere und schonendere Krebstherapien ebnen.