Stickstoff ist das am häufigsten vorkommende Element in der Erdatmosphäre, existiert jedoch in der Natur fast ausschließlich als molekularer Stickstoff N2. Aufgrund seiner Stabilität besitzt N2 eine sehr starke Dreifachbindung zwischen den beiden Stickstoffatomen, was das Element äußerst inert macht. Diese Eigenschaft ist nicht nur für das Leben auf der Erde essentiell, sondern stellt auch eine chemische Herausforderung dar, wenn es darum geht, andere Stickstoff-Allotrope zu erzeugen. Polynitrogene, also Verbindungen, die ausschließlich aus mehreren Stickstoffatomen bestehen, gelten als vielversprechende Kandidaten für Hochenergie-Materialspeicher, da ihre Zersetzung enorme Energiemengen freisetzen kann, ohne umweltschädliche Rückstände zu hinterlassen. Doch die Synthese neutraler, molekularer Stickstoff-Allotrope jenseits von N2 war lange Zeit ein unerreichbares Ziel, da solche Spezies als extrem reaktiv und instabil galten.
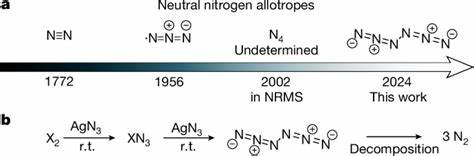
Die kürzlich veröffentlichte Forschung zur Vorbereitung eines neutralen Hexanitrogen-Allotrops mit der Symmetrie C2h-N6 hat dieses Paradigma grundlegend verändert. Die Grundlage dieser Entdeckung beruht auf der Reaktion von halogenen Gasen wie Chlor (Cl2) oder Brom (Br2) mit Silberazid (AgN3) unter reduzierterem Druck bei Raumtemperatur. Die dabei entstehenden Elemente werden anschließend bei ultrakalten Temperaturen in Argon-Matrizen bei 10 Kelvin eingefroren, was die kurzlebigen Moleküle stabilisiert und somit spektroskopisch nachweisbar macht. Sogar die Bildung eines reinen Films von N6 bei der höheren Temperatur von flüssigem Stickstoff (77 Kelvin) konnte beobachtet werden, was überraschende Stabilität aufzeigt. Diese experimentellen Befunde werden durch Dispersions-, Infrarot- und UV-Vis-Spektroskopie bestätigt, ergänzt durch isotopenmarkierte Experimente mit 15N sowie fundierte theoretische Rechnungen.
Die Existenz neutraler Stickstoff-Allotrope wie N6 steht im Gegensatz zu bisherigen Erwartungen, da der Zerfall in mehrere N2-Moleküle sehr energetisch begünstigt ist. Dennoch besitzt dieses neutral gebundene Molekül eine bemerkenswerte kinetische Stabilität mit einer Berechnungen zufolge ausreichend hohen Barriere gegen Zersetzung, sodass es bei niedrigen Temperaturen für ausreichend lange Zeiten existiert. So konnte die Halbwertszeit bei 77 Kelvin auf mehr als 130 Jahre geschätzt werden, während sie bei Raumtemperatur im Millisekunden-Bereich liegt – genug, um es quasi in der Gasphase erzeugen und dann einfrieren zu können. Strukturell zeichnet sich das C2h-N6-Molekül durch zwei Ketten von Azid-Gruppen (N3) aus, die über eine zentrale Einfachbindung verbunden sind. Im Gegensatz zum bekannten molekularen Stickstoff (N2) sind hier komplexere Bindungsverhältnisse mit Mehrfachbindungen zu beobachten, die durch Quantenchemie-berechnungen bestätigt und mit natürlichen Bindungsorbitalen erläutert werden konnten.
Interessanterweise sind die terminalen Stickstoffatome elektronisch neutral, während sich im inneren Kettenbereich sowohl positive als auch negative Ladungsverteilungen finden lassen, was für eine delokalisierte elektronische Struktur spricht. Die energetischen Potenziale von N6 heben dieses Molekül als Kandidat für neuartige, nachhaltige Energiespeicher hervor. Die exotherme Zersetzung in N2 setzt eine Energiemenge frei, die verglichen mit heutigen Sprengstoffen wie TNT oder HMX das Mehrfache an Energie pro Masseneinheit liefern kann. Dabei zerfällt das Molekül zu vollständig ungiftigem Stickstoffgas, was einen enormen Vorteil gegenüber herkömmlichen chemischen Energiespeichern darstellt, die oftmals giftige oder umweltschädliche Zersetzungsprodukte hinterlassen. Das Potenzial dieser Entdeckung geht jedoch über energetische Anwendungen hinaus: Das Verständnis und die Kontrolle neutraler Stickstoff-Allotrope eröffnen neue wissenschaftliche Horizonte.
Bisher waren nur wenige neutrale polymere Stickstoffverbindungen bestätigt, darunter das Azid-Radikal und einige schwere Ionen. Die Vorstellung, dass reine Stickstoffmoleküle jenseits von N2 existieren und bei geringen Temperaturen stabil sind, kann die Erforschung von molekularen Materialsystemen, elektronischen Eigenschaften und sogar chemischen Reaktionsmechanismen maßgeblich beeinflussen. Der Syntheseweg von C2h-N6 setzt auf das reaktive Silberazid als Ausgangsstoff, das in trovarener Menge mit gasförmigem Chlor bzw. Brom umgesetzt wird. Die entstandenen Reaktionsprodukte werden schnell auf ultrakalte Argon-Oberflächen gefroren, um sie vor sofortiger Zersetzung zu schützen.
Die charakteristischen Infrarotspektren zeigen vier intensive Signale, die durch computergestützte Modellierungen als Schwingungen von N6 identifiziert wurden. Besondere Aufmerksamkeit erhielt die Zuweisung eines Bandes, das sich als Fermi-Resonanz einer kombinierten Schwingung herausstellte, was die einzigartige Struktur von C2h-N6 unterstreicht. Die darauf folgenden Anregungs- und Zerfallsversuche mittels UV-Licht bestätigten die Reaktivität und die kinetische Beharrlichkeit dieses Allotrops. Der Einsatz von Isotopenmarkern mit 15N erlaubte ein noch detaillierteres Bild der molekularen Verteilung und bestätigte schließlich die Hypothese der doppelten Azidstrukturen in C2h-N6. Durch diese Technik konnten subtile Verschiebungen der Spektrallinien beobachtet werden, die sich perfekt mit den theoretischen Vorhersagen deckten.
Weitere zwei-photonen-spektroskopische Untersuchungen veranschaulichen zudem, dass die Elektronenstruktur von N6 elektronische Übergänge aufweist, die mit bekannten π→π* Übergängen in organisch aromatischen Verbindungen vergleichbar sind. Interessanterweise wurde der Aufschluss über die elektronische Struktur durch Methoden wie die Laplacian-Elektronendichteanalyse und die Elektron-Lokalisationsfunktion vertieft. Diese gaben Aufschluss über lokale Schwächen im Molekül, besonders an den Bindungen, die potenzielle Zerfallspunkte darstellen. Die Berechnungen zeigten dabei, dass das Molekül nicht primär durch Bruch der zentralen Einfachbindung in zwei Azidradikale zerfällt, sondern eher durch eine simultane Spaltung in drei N2-Einheiten, was den beobachteten Barrieren entspricht. Diese Erkenntnisse sind wichtig, um die potenzielle Nutzung von N6 als energiegeladenes, aber kontrollierbares Material einschätzen zu können.
Die Sicherheitsaspekte bei der Handhabung von Silberazid und vor allem von Halogenaziden sind nicht zu unterschätzen. Beide Verbindungen sind hochexplosiv und erfordern ein hohes Maß an Schutzmaßnahmen. Die Arbeit mit diesen Substanzen darf ausschließlich in speziell dafür eingerichteten Laboren erfolgen, mit persönlicher Schutzausrüstung und unter Vermeidung von statischer Elektrizität, mechanischer Belastung oder Lichtquellen, die Reaktionen auslösen können. Dennoch zeigt die Studie, dass es unter kontrollierten Bedingungen möglich ist, ein solches instabiles Molekül erfolgreich zu synthetisieren, zu analysieren und sogar in reiner Form zu kondensieren. Die Entdeckung des neutralen Hexanitrogen-C2h-N6-Allotrops bildet auch eine wichtige Brücke zur Festkörperchemie, in der bereits polymerer, kubisch-gauche Stickstoff unter extremen Druck- und Temperaturbedingungen hergestellt wurde.
Hierbei handelt es sich allerdings nicht um molekulare Verbindungen, sondern um vernetzte Netzwerke. Die molekulare Variante N6 steht dagegen beispielhaft für eine Neue Klasse kinetisch stabiler polymolecularer Stickstoffverbindungen, die künftig als Grundlage für neue Hochleistungsmaterialien dienen könnten. Die energetische Bewertung von N6 kommt zu dem Schluss, dass dieser Stoff hinsichtlich Detonationsgeschwindigkeit und Detonationsdruck sehr konkurrenzfähig mit bekannten Sprengstoffen ist. Dabei ist die mögliche Energiedichte aufgrund der hohen Bildungenthalpie und Molekülmasse extrem hoch, was den Stoff geradezu als „grünen Sprengstoff“ kategorisieren könnte. Gleichzeitig erzeugt der Zerfall ausschließlich gasförmigen Stickstoff, was ihn hinsichtlich Umweltschutz und Entsorgung sehr attraktiv macht.





![Stochastic Parrots All the Way Down(2025) [pdf]](/images/33B4A291-CF5F-4161-8328-5255BB208B10)