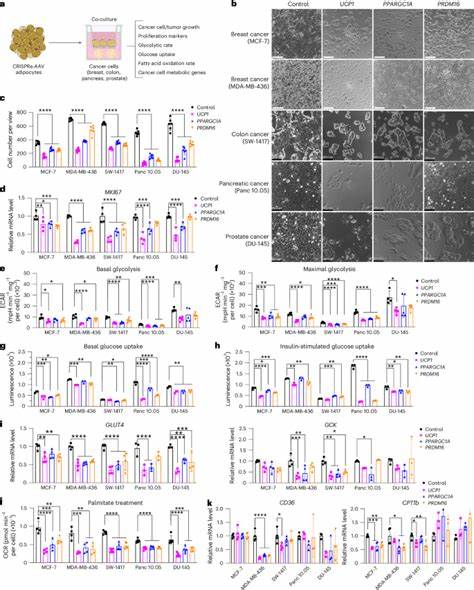
Krebs ist eine der führenden Todesursachen weltweit und stellt trotz zahlreicher Fortschritte in Diagnostik und Therapie weiterhin eine enorme Herausforderung für die Medizin dar. Tumore sind nicht nur durch ihre unkontrollierte Zellteilung charakterisiert, sondern auch durch ihre Fähigkeit, ein komplexes Mikroenvironment zu kreieren, in dem sie bevorzugt Nährstoffe und Sauerstoff konkurrieren und somit ihr schnelles Wachstum unterstützen. Forschungsergebnisse zeigen, dass die Stoffwechselflexibilität und Anpassung der Krebszellen an die Umgebung eine entscheidende Rolle bei der Tumorentwicklung spielen. In diesem Zusammenhang rückt ein neuartiger Therapieansatz in den Mittelpunkt: die Implantation ingenieurtechnisch modifizierter Adipozyten (Fettzellen), die das Tumorwachstum durch metabolischen Wettbewerb signifikant reduzieren können. Adipozyten, die Hauptbestandteile des Fettgewebes, sind aufgrund ihrer metabolischen Aktivität und ihrer Fähigkeit, große Mengen an Glukose und Fettsäuren aufzunehmen und zu verstoffwechseln, eine vielversprechende Zellpopulation für therapeutische Interventionen.
Insbesondere die Umwandlung von weißen Fettzellen in sogenannte beige oder braune Adipozyten – ein Vorgang bekannt als „Browning“ – kann den Energieverbrauch durch Wärmeerzeugung (Thermogenese) erhöhen und somit den metabolischen Verbrauch steigern. Dieses Prinzip wurde genutzt, um adipöse Zellen so zu modifizieren, dass sie Tumorzellen im Wettbewerb um Nährstoffe überlegen sind. Die technische Grundlage dieser Strategie ist die sogenannte CRISPRa-Technologie (CRISPR Aktivierung), mit deren Hilfe gezielt Gene in Adipozyten hochreguliert werden können. Wichtigste Zielgene sind dabei UCP1, PPARGC1A und PRDM16, alle maßgeblich an der Entwicklung und Funktion von braunem Fettgewebe beteiligt. Durch die Aktivierung dieser Gene in weißen Adipozyten werden diese energetisch aktiver, erhöhen ihre Glukose- und Fettsäureaufnahme und -oxidation und übernehmen quasi die metabolische Kontrolle über Tumorzellen.
Somit entziehen sie den malignen Zellen lebenswichtige Ressourcen und hemmen deren Wachstum. In Labor- und Tiermodellen wurden diese modifizierten Adipozyten in Form von 3D-Adipozyten-Organoiden neben Tumoren oder Tumorzelllinien transplantiert. Die Ergebnisse sind beeindruckend: Bei verschiedenen Krebsarten wie Brust-, Darm-, Pankreas- und Prostatakrebs konnte eine signifikante Verkleinerung der Tumorgröße beobachtet werden. Dabei führten die implantierten Adipozyten nicht nur zu einer Reduktion der Zellproliferation, sondern auch zu einer verringerten Sauerstoffarmut (Hypoxie) und verminderten Neubildung von Blutgefäßen (Angiogenese), was die Tumorprogression weiter einschränkt. Die erhöhte Apoptoserate in den Tumoren weist zudem auf eine gesteigerte Tumorzellsterblichkeit hin.
Ein weiterer faszinierender Aspekt ist die Möglichkeit, den Effekt der in den Adipozyten aktivierten Gene induzierbar und reversibel zu steuern. So wurde mit einer tetracyclininduzierten CRISPRa-Variante gezeigt, dass die Genaktivierung in den Adipozyten bei Bedarf ein- und ausgeschaltet werden kann. Dies erhöht die Flexibilität und Sicherheit dieser potenziellen Therapieform und erlaubt eine präzise Anpassung an den Krankheitsverlauf. Neben der gezielten Steuerung des Glukose- und Fettstoffwechsels wurde zudem ein zusätzlicher, cancerspezifischer Ansatz erforscht: Die Hochregulierung des UPP1-Gens in Adipozyten, was besonders bei Pankreaskarzinomen wirksam ist, die auf Uridin als metabolische Ressource angewiesen sind. Auch hier zeigte sich, dass die modifizierten Fettzellen in einem metabolischen Wettbewerb die Tumorzellen an Uridin vorbeiziehen und somit deren Wachstum hemmen können.
Diese „maßgeschneiderte“ Modifikation ermöglicht eine personalisierte Therapie, die an die jeweilige metabolische Abhängigkeit des Tumors angepasst werden kann. Die Vorteile dieses adipösen Manipulationstransplantationskonzepts (AMT) liegen auf der Hand. Hierbei wird ein patienteneigenes Gewebe verwendet, das einfach in der Klinik mittels Liposuktion gewonnen und nach ex vivo Modifikation wieder transplantiert werden kann. Da Adipozyten im Allgemeinen eine geringe immunogene Reaktion hervorrufen, verringert sich das Risiko von Abstoßungsreaktionen, was gegenüber anderen Zelltherapien ein gewichtiger Pluspunkt ist. Organotypische 3D-Adipozyten-Organoide bieten eine biologisch realistischere Umgebung und ermöglichen eine bessere Integration und Funktionalität nach der Transplantation.
Zudem erlauben technische Innovationen wie die Mikrowell-Scaffold-Plattformen, die eine kontrollierte und stabile Implantation ermöglichen, eine weitere Optimierung der Therapie und erleichtern eine gezielte Entfernung oder Ersetzung von transplantiertem Material bei Bedarf. Trotz der vielversprechenden Ergebnisse gibt es wichtige Herausforderungen zu beachten. Bei prolongierten Behandlungszeiträumen könnte es theoretisch zu unerwünschten Nebenwirkungen wie der Kachexie, dem krankhaften Verlust von Muskel- und Fettmasse, kommen, da braunes Fettgewebe den Energieverbrauch stark steigern kann. Deshalb ist die Fähigkeit zur reversiblen Genaktivierung und die kontrollierte Entfernung der implantierten Zellen essenziell für die klinische Anwendung. Darüber hinaus gilt es, die optimale Zellzahl, das Transplantationsverfahren und die Kombination mit konventionellen Krebstherapien weiter zu erforschen.
Die zunehmende Evidenz für den Zusammenhang von Stoffwechselkrankheiten wie Fettleibigkeit, Diabetes und Krebs unterstreicht die Bedeutung des AMT-Ansatzes: Da braunes Fettgewebe die Glukosehomöostase und Insulinsensitivität verbessert, könnte diese Therapieform in Zukunft sogar zwei Fliegen mit einer Klappe schlagen – gleichzeitig Tumorwachstum hemmen und metabolische Syndrome lindern. Zahlreiche Studien belegen, dass Hyperinsulinämie und erhöhte Insulinspiegel die Tumorprogression fördern, da Insulin als Wachstumsfaktor fungiert. Die implantierten, modifizierten Adipozyten senken Systeminsulinspiegel und verbessern die Glukoseaufnahme, was indirekt ebenfalls das Tumorwachstum bremsen kann. Somit wirkt AMT sowohl direkt metabolisch – durch Ressourcenkonkurrenz – als auch durch Verbesserung des systemischen Stoffwechselprofils einer krebskranken Person. Die Integration von AMT in bestehende Behandlungskonzepte eröffnet vielversprechende Optionen.
Der Ansatz könnte mit Chemotherapie, Bestrahlung oder Immuntherapien kombiniert werden, um synergistische Effekte zu erzielen. Da die Technologie weiterhin verfeinert wird, ist mit einer zunehmenden Individualisierung der Therapie zu rechnen, bei der die spezifischen metabolischen Besonderheiten eines jeden Tumors analysiert und durch einzelne oder multiple Zielgene in Adipozyten adressiert werden. Fazit: Die Implantation von genetisch modifizierten Adipozyten stellt einen innovativen, biologisch fundierten Ansatz zur Hemmung von Tumorwachstum dar. Durch das Ausnutzen der natürlichen metabolischen Kapazität von Fettzellen und gezielte genetische Modifikation können adipöse Zellen als metabolische Konkurrenten die Ressourcen von Tumoren abschnüren und deren Wachstum dramatisch einschränken. Die breite Wirkungsweise gegen verschiedene Krebsarten, die Möglichkeit zur Induzierbarkeit und Personalisierung sowie die potenzielle geringe Immunogenität machen diese Therapie zu einer der spannendsten Entwicklungen in der onkologischen Zelltherapie der letzten Jahre.
Mit weiteren klinischen Studien und technischen Verbesserungen könnte diese Methode künftig zu einer wichtigen Ergänzung der Krebsbehandlung werden und vielen Patientinnen und Patienten neue therapeutische Perspektiven eröffnen.