Das Glaukom ist eine komplexe neurodegenerative Erkrankung, die weltweit zu einer der häufigsten Ursachen für irreversible Erblindung zählt. Charakteristisch ist der Verlust von retinalen Ganglienzellen (RGCs), den Ausgangsneuronen der Netzhaut, deren Funktion entscheidend für das Sehen ist. Trotz der umfangreichen Forschung stehen derzeit keine wirksamen neuroprotektiven Therapien zur Verfügung. Die Behandlung konzentriert sich vor allem auf die Senkung des Augeninnendrucks (intraokulärer Druck, IOD), welcher als Hauptrisikofaktor gilt, aber trotz Kontrolle leiden viele Patienten unter fortschreitendem Sehverlust. Vor diesem Hintergrund rückt der Stoffwechsel in den Fokus der Forschung und bietet neue Ansatzpunkte für neuroprotektiven Schutz.
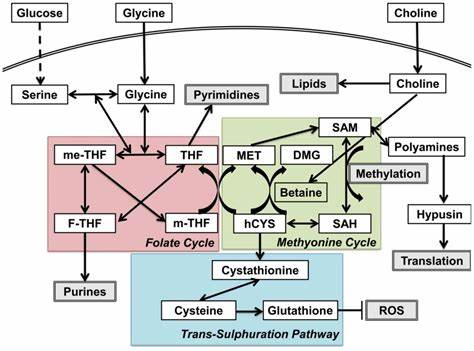
Ein besonders interessanter Weg ist der sogenannte Ein-Kohlenstoff-Stoffwechsel (one-carbon metabolism), ein biochemischer Prozess, der essenzielle zelluläre Funktionen wie DNA-Methylierung, Aminosäuresynthese und antioxidative Mechanismen steuert. Eine bedeutende Verbindung innerhalb dieses Stoffwechsels ist Homocystein, eine schwefelhaltige Aminosäure, deren Erhöhung mit verschiedenen Erkrankungen, darunter Alzheimer oder Herz-Kreislauf-Leiden, in Zusammenhang gebracht wird. Neueste Untersuchungen zeigen, dass in Glaukommodellen eine Dysfunktion des Ein-Kohlenstoff-Stoffwechsels vorliegt, gekennzeichnet durch erhöhte Homocysteinwerte in der Netzhaut und einen veränderten Ausdruck enzymatischer Schlüsselstellen in Augenstrukturen. Interessanterweise stellt sich heraus, dass der bloße Anstieg von Homocystein im Auge allein nur eine milde Verschlechterung des Ganglienzellverlustes bewirkt. Tierexperimente mit gezielter Erhöhung von Homocystein im Glaskörper zeigen keine signifikante Degeneration der Ganglienzellen ohne zusätzlichen Stressfaktor.
Erst in Kombination mit erhöhtem Augeninnendruck verschärft Homocystein den Zellverlust leicht. Diese Befunde sprechen dafür, dass Homocystein eher als Marker eines gestörten Stoffwechselzustands zu verstehen ist, nicht als direkter Verursacher der Neurodegeneration. Tiefere molekulare Analysen in Glaukom-Tiermodellen enthüllen, dass die Dysfunktion des Ein-Kohlenstoff-Stoffwechsels zu einer gestörten Regulation von Kern- und Mitochondriengenen führt, die an Methioninzyklus, Folsäurezyklus und Transsulfurierung beteiligt sind. Dabei fallen insbesondere die veränderte Expression von Methioninsynthase (Mtr) und Cystathionin-β-Synthase (Cbs) ins Auge, Enzyme, die für die Homocysteinverwertung essentiell sind und deren Verlust mit Anhäufung von Homocystein korreliert. Weiterhin zeigen Untersuchungen, dass beim Glaukom nicht nur die Stoffwechselwege selbst, sondern auch die Aufnahme und Verwertung der essenziellen Cofaktoren und Vorläufermoleküle beeinträchtigt sind.
Die wichtigen Vitamine B6 (Pyridoxin), B9 (Folsäure), B12 (Cobalamin) und das essentielle Molekül Cholin stehen im Zentrum dieses gestörten Systems. Ihre Funktionen umfassen die Bereitstellung aktiver Cofaktoren für Enzyme des Methionin- und Folsäurezyklus sowie den Schutz vor oxidativem Stress und Unterstützung der DNA-Methylierung, die für die Erhaltung der neuronalen Gesundheit kritisch ist. Vor diesem Hintergrund hat sich die Frage gestellt, ob eine gezielte Supplementierung dieser Vitamine neuroprotektive Effekte bei Glaukommodellen zeigen könnte. In Tierversuchen wurde die orale Gabe von Vitamin B6, B9, B12 und Cholin vor und während der Induktion eines erhöhten Augeninnendrucks getestet. Ergebnis war eine signifikante Erhaltung der RGC-Dichte und eine Verbesserung der visuellen Funktion, gemessen mittels elektrophysiologischer Tests.
Besonders in einem chronischen Modell mit nur leicht erhöhtem Augeninnendruck verhinderten die vitaminreichen Nahrungsergänzungen nahezu vollständig den Verlust an Ganglienzellen und deren Funktionsfähigkeit. Wichtig ist dabei, dass diese neuroprotektiven Effekte unabhängig von der Beeinflussung des Augeninnendrucks nachgewiesen wurden, was auf einen direkten zellulären Schutzmechanismus hinweist. Die Vitamine scheinen die stoffwechselbedingte Dysfunktion des Ein-Kohlenstoff-Stoffwechsels zumindest teilweise zu kompensieren und so pathologische Prozesse aufzuhalten oder zu verzögern. Menschliche Daten aus großen Kohorten gehorchen diesem Prinzip auch teilweise. Die genetische Disposition für erhöhte Homocysteinspiegel zeigt keinen klaren Einfluss auf das Risiko für Glaukom oder den Verlauf der Erkrankung.
Ebenso wurde in einer kontrollierten Patientenstudie keine Beziehung zwischen Serum-Homocysteinspiegeln und der Verschlechterung des visuellen Feldes nachgewiesen. Dennoch deutet die dysregulierte Expression von Genen im Ein-Kohlenstoff-Stoffwechsel, insbesondere in den retinalen Ganglienzellen, auf eine etwaige zentrale Rolle solch metabolischer Störungen als begleitende Pathomechanismen beim menschlichen Glaukom hin. Die Herausforderung liegt nun darin, die vielversprechenden präklinischen Erkenntnisse in klinische Anwendungen zu übertragen. Die gewählten Vitamine besitzen bereits gut etablierte Sicherheitsprofile, was eine schnelle klinische Bewertung erlaubt. Die Dosierungen, welche in den Tierversuchen neuroprotektive Effekte zeigten, müssten auf humanäquivalente Werte umgerechnet werden, und mögliche Nebenwirkungen berücksichtigt werden, insbesondere im Hinblick auf die Folsäuregabe, welche bei unkontrolliertem Einsatz perniziöse Anämien durch Maskierung anderer Vitaminmängel verursachen kann.
Durch gute Planung und begleitende Kontrolle können diese Risiken minimiert werden. Die potenzielle Kombination mit existierenden Therapien, die den Augeninnendruck senken, eröffnet neue Perspektiven für additive oder synergistische neuroprotektive Strategien, die über die herkömmlichen Druck-senkenden Maßnahmen hinausgehen und das Fortschreiten der Erkrankung verlangsamen oder sogar verhindern können. Zusammenfassend markieren erhöhte Homocysteinwerte in der Retina nicht die Ursache, sondern vielmehr ein Symptom eines gestörten Ein-Kohlenstoff-Stoffwechsels bei Glaukom. Die hierfür essenziellen Cofaktoren Vitamin B6, B9, B12 und Cholin sind im Krankheitsgeschehen dysreguliert und ihre Supplementierung zeigt in Tiermodellen einen klaren neuroprotektiven Effekt, der Aussicht auf translationale Anwendung beim Menschen gibt. Die Bedeutung des Ein-Kohlenstoff-Stoffwechsels für die neuronale Gesundheit könnte auch über das Glaukom hinausgehen und Einfluss auf andere neurodegenerative Netzhauterkrankungen oder zentrale neurodegenerative Prozesse haben.
Daher eröffnet die Betrachtung metabolischer Pfade und deren Anpassung durch essentielle Nährstoffe und Vitamine einen vielversprechenden Weg, neurodegenerativen Erkrankungen durch gezielte Prävention und Therapie entgegenzuwirken. Zukünftige Forschungsarbeiten werden sich darauf konzentrieren, die molekularen Mechanismen, durch die diese Vitamine Schutz bieten, besser zu verstehen und ihre Wirksamkeit in klinischen Studien zu validieren. Auch die Identifikation geeigneter Biomarker für Dysfunktionen des Ein-Kohlenstoff-Stoffwechsels und deren Umkehr durch Interventionen könnte helfen, personalisierte Therapien zu entwickeln, die den individuellen metabolischen Bedürfnissen von Glaukompatienten gerecht werden. In der Gesamtschau stellt die Entdeckung, dass dysfunktionaler Ein-Kohlenstoff-Stoffwechsel und seine vitaminbedingten Cofaktoren eine entscheidende Rolle bei der Neuroprotektion spielen, eine wichtige Ergänzung im Verständnis der Glaukompathophysiologie dar und bietet einen realistischen Ansatzpunkt zur Entwicklung neuer Behandlungsstrategien, die das Ziel verfolgen, das Sehvermögen nachhaltig zu erhalten.