Der Geschmack von Süßem gehört zu den grundlegendsten und beliebtesten Sinneseindrücken des Menschen. Schon von Geburt an verbinden wir Süßes mit Nahrung, Energie und Wohlbefinden. Doch wie entsteht eigentlich das Empfinden von Süße auf molekularer Ebene? Dank neuester Forschungsergebnisse, insbesondere unter Einsatz der Kryo-Elektronenmikroskopie (cryo-EM), verstehen Wissenschaftler heute die Struktur des menschlichen Süßrezeptors in bisher unerreichter Tiefe. Diese Erkenntnisse bieten nicht nur einen Einblick in die Biologie des Geschmackssinns, sondern eröffnen auch neue Perspektiven für die Entwicklung von Süßungsmitteln und Geschmacksmodulatoren. Im menschlichen Mund übernehmen spezialisierte Geschmackszellen auf der Zunge die Aufgabe, süße Substanzen zu erkennen.
Verantwortlich dafür ist ein heterodimerer G-Protein-gekoppelter Rezeptor (GPCR), der aus zwei Untereinheiten besteht: TAS1R2 und TAS1R3. Während TAS1R3 auch in der Umami-Erkennung eine Rolle spielt, ist TAS1R2 spezifisch für den Süßgeschmack. Nur gemeinsam bilden sie einen funktionsfähigen Rezeptorkomplex, der eine Vielzahl von süß schmeckenden Molekülen erkennen kann – von natürlichen Zuckern bis hin zu künstlichen Süßstoffen wie Sucralose und Aspartam. Die molekulare Architektur dieses Rezeptors ähnelt anderen Mitgliedern der Klasse C GPCRs, die neben Geschmacksrezeptoren auch neurochemische Rezeptoren wie Metabotrope Glutamatrezeptoren (mGluRs) und GABA extsubscript{B}-Rezeptoren umfassen. Jede der Untereinheiten verfügt über eine extrazelluläre „Venusfliegenfalle“-Domäne (VFT), die den Liganden bindet, eine zysteinreiche Bereichsverbindung (CR) und eine transmembrane Domäne (TM) mit sieben Helices.
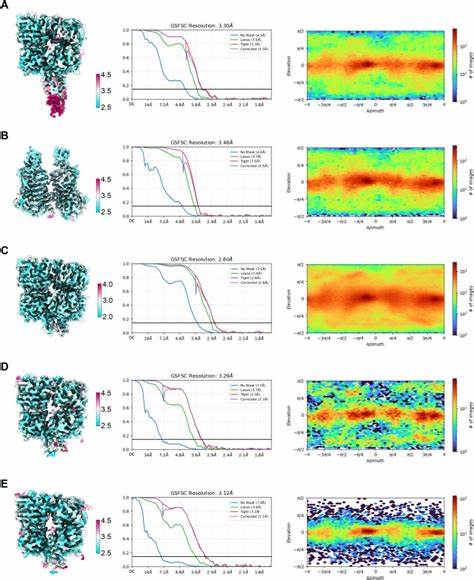
Die VFT-Domänen von TAS1R2 und TAS1R3 sitzen nebeneinander und bilden einen kompakten Komplex. Dabei sorgt TAS1R2 für die Bindung der süßen Moleküle und vermittelt gleichzeitig die Ankopplung an das G-Protein, das die nachgeschaltete Signalübertragung aktiviert. Durch die Anwendung von cryo-EM konnten Wissenschaftler die 3D-Struktur des menschlichen Süßrezeptors in komplex mit den populärsten künstlichen Süßstoffen Sucralose und Aspartam aufklären. Diese Methode liefert hochauflösende Bilder, aus denen genaue Modelle der Molekülinteraktionen erzeugt werden konnten. Es stellte sich heraus, dass beide Süßstoffe im gleichen Bindungstasche der TAS1R2-VFT-Domäne andocken.
Diese Tasche ist speziell darauf ausgelegt, vielfältige süße Substanzen mit unterschiedlicher chemischer Struktur zu erkennen. Die Bindung führt dazu, dass sich die zwei Lobes (LB1 und LB2) der VFT-Domäne von TAS1R2 um das Molekül 'zusammenklappen'. Dieses Schließen stärkt die Interaktion und initiiert die Konformationsänderungen, die letztlich zu einer Aktivierung des Rezeptorkomplexes führen. Die TAS1R3-Untereinheit bleibt in dieser Phase offen, trägt jedoch wesentlich zur Stabilität des Rezeptorkomplexes bei und ermöglicht die funktionelle Aktivierung durch TAS1R2. Diese asymmetrische Wechselwirkung zwischen den Untereinheiten ist ein charakteristisches Merkmal der Klasse C GPCRs.
Mutagenese-Studien ergänzen diese strukturellen Erkenntnisse und bestätigen die Bedeutung bestimmter Aminosäurereste in der Bindungsregion für die Erkennung von Süßstoffen. Werden diese Schlüsselstellen verändert, z.B. durch das Ersetzen von Tyrosin oder Asparaginsäureresten durch Alanin, so ist die Rezeptorantwort auf die Süßstoffe stark verringert oder komplett aufgehoben. Das zeigt die Präzision, mit der der Rezeptor seine Liganden selektiert und bindet.
Interessanterweise haben sich evolutionär auch Unterschiede in der Süßstofferkennung zwischen verschiedenen Säugetierarten entwickelt. So reagieren Menschen und manche Primaten auf Aspartam, während viele Nagetiere und andere Affenarten keinen Süßgeschmack daran feststellen. Die besprochenen Studien zeigen, dass diese Unterschiede nicht auf Variationen in den offensichtlichen Bindungsstellen zurückzuführen sind, sondern wahrscheinlich auf subtile Veränderung anderswo in TAS1R2. Während die Bindung der süßen Moleküle an die VFT-Domäne den ersten Schritt in der Signalübertragung darstellt, sorgen Veränderungen in der CR-Domäne und den Transmembrandomänen dafür, dass das Signal an das G-Protein weitergeleitet wird. In der aktivierten Form rücken bestimmte Helices – insbesondere TM6 – der Untereinheiten näher zusammen, was für die Aktivierung klassischer GPCR-Signalwege typisch ist.
Die G-Protein-Kopplung erfolgt ausschließlich über TAS1R2, wohingegen TAS1R3 keine direkte G-Protein-Interaktion zeigt, jedoch für korrekte Rezeptorfunktion unverzichtbar ist. Neben dem Grundlagenwissen schafft die Enthüllung der Rezeptorstruktur ein neues Werkzeug für die Lebensmittel- und Pharmaindustrie. Künstliche Süßstoffe werden heute vielfach eingesetzt, um kalorienarme oder -freie Süße zu erzielen. Ein molekulares Verständnis, wie diese Stoffe an den Rezeptor binden und diesen aktivieren, könnte die rationale Entwicklung von neuen Süßstoffen mit optimiertem Geschmacksprofil und verbesserten Sicherheitseigenschaften ermöglichen. Ebenso bieten sich Ansätze, Rezeptoraktivität gezielt zu modulieren, beispielsweise durch molekulare Allosterie, um Geschmackswahrnehmungen zu beeinflussen.
Darüber hinaus erklärt die relativ geringe Affinität des Süßrezeptors zu natürlichen Zuckern aus biologischer Sicht den Vorteil für den Organismus: Millimolare Bindungsstärke verhindert eine schnelle Sättigung und erlaubt es Tieren, unterschiedliche Konzentrationen von Zuckern im Nahrungsangebot differenziert wahrzunehmen und auswählen zu können. Die feine Balance zwischen Rezeptorsensitivität und Verfügbarkeit von Energiequellen ist somit evolutiv vorteilhaft. Trotz der Fortschritte gibt es noch offene Fragen. So fehlt bislang die Struktur des apo-Rezeptors (ohne gebundenen Liganden), was für ein vollständiges Verständnis der Aktivierungsmechanismen wichtig wäre. Auch die Struktur mit natürlichen Zuckern in unterschiedlichen Konzentrationen oder mit anderen Klassen süßer Substanzen steht noch aus.
Zudem könnten polymorphe Varianten des TAS1R2/TAS1R3-Rezeptors in der menschlichen Bevölkerung mit verschiedenen Geschmacksempfindlichkeiten korrelieren, was für personalisierte Ernährung und Gesundheitsfragen relevant sein könnte. Zusammenfassend bietet die moderne strukturelle Aufklärung des menschlichen Süßrezeptors einen tiefergehenden Einblick in die Biochemie und Physiologie des Geschmackssinns. Die Kombination aus hochauflösenden cryo-EM-Aufnahmen, funktionellen Mutagenese-Experimenten und molekularen Simulationen erzeugt ein ganzheitliches Bild, wie der Mensch Süße wahrnimmt. Diese Erkenntnisse verdienen nicht nur wissenschaftliche Anerkennung, sondern besitzen auch großes Potenzial, die Zukunft der Nahrungsmittelentwicklung und geschmacklichen Optimierung nachhaltig zu beeinflussen.