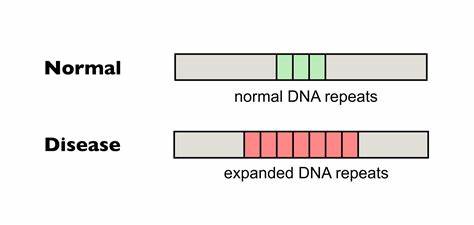
Die Huntington-Krankheit (HD) ist eine neurodegenerative Erkrankung, die durch eine pathologische Expansion von CAG-Trinukleotid-Wiederholungen im Huntingtin-Gen (HTT) verursacht wird. Diese verlängerten Repeat-Sequenzen führen zu einer abnormen Verlängerung der Polyglutamin-Kette im Huntingtin-Protein, was letztlich neuronale Degeneration, vor allem im Striatum und Kortex, hervorruft. Ein charakteristisches Merkmal der Erkrankung ist die somatische Instabilität der CAG-Repeats, die sich mit zunehmendem Alter verstärkt und den Krankheitsverlauf verschärft. Somatische Repeat-Expansionen bedeuten, dass die Anzahl der Wiederholungen in Körperzellen, insbesondere im Gehirn, wächst und dadurch die Krankheitssymptome beschleunigt oder verstärkt werden. Somit ist die Kontrolle oder Reduktion dieser somatischen Expansionen ein vielversprechendes therapeutisches Ziel bei HD.
Die wissenschaftliche Forschung hat in den letzten Jahren enorme Fortschritte im Bereich der präzisen Genom-Editierung verzeichnet, insbesondere durch die Entwicklung von sogenannten Basen-Editoren. Diese Technologie ermöglicht die gezielte Veränderung einzelner Nukleotide ohne den Einsatz von Doppelstrangbrüchen, was wiederum potenziell schädliche DNA-Reparaturmechanismen minimiert. In Bezug auf die Huntington-Krankheit bietet sich die Möglichkeit, die rein repetitiven CAG-Sequenzen durch Basen-Editoren mit sogenannten Unterbrechungen (Interruptions) zu versehen. Solche Unterbrechungen, beispielsweise die Umwandlung von CAG zu CAA (beide codieren für die Aminosäure Glutamin), sind bekannt dafür, die Stabilität der Repeat-Sequenz zu erhöhen und somatische Expansionen zu verlangsamen oder gar zu verhindern. Neueste Studien demonstrieren, dass der Einsatz von Cytosin-Basen-Editoren (CBEs) in Verbindung mit einer gezielten Führung durch sgRNAs (single guide RNAs) zu einer effizienten Einführung von CAA-Unterbrechungen in patienteneigenen Zellen geführt hat.
Experimente mit fibroblastären Zelllinien von HD-Patienten zeigten, dass ein signifikanter Anteil der HTT-Allele innerhalb kurzer Zeit nach Behandlung sequenzierte CAA-Unterbrechungen aufwies. Darüber hinaus beeinflusste diese Editierung die Dynamik der Repeat-Länge: Während in unbehandelten Zellen eine progressive Zunahme der CAG-Wiederholungen über mehrere Zellteilungen beobachtet wurde, stabilisierten sich im Genehmigungsverfahren editierte Zellen auf einem niedrigeren und stabileren Niveau. Sogar eine leichte Verkürzung der Repeat-Länge unter die Ausgangslänge konnte nachgewiesen werden. Die Bedeutung solcher Unterbrechungen wurde auch epidemiologisch belegt. Menschen, die von Natur aus solche Interruptions in ihrem HTT-Gen tragen, zeigen eine deutlich verzögerte Krankheitsmanifestation um Jahre bis Jahrzehnte hinaus.
Das spricht für die therapeutische Relevanz der Generierung solcher Sequenzvarianten mittels Basen-Editierung. Neben den in vitro Studien wurden auch Tiermodelle der Huntington-Krankheit untersucht. Eine häufig verwendete Mauslinie, die Htt.Q111-Maus, besitzt eine humane HTT-Allele mit hochpathogener CAG-Repeat-Länge. Die Verabreichung optimierter AAV9-Adeno-assoziierter Viren, die den Basen-Editor sowie die passende sgRNA exprimieren, führte zu einer effizienten genomischen Editierung in zentralnervösen Geweben wie Kortex und Striatum.
Dort konnten bis zu 76% der untersuchten Allele Unterbrechungen aufweisen, was parallel mit einer signifikanten Reduktion der somatischen Repeat-Expansion einherging. Sogar die Verteilung der Repeat-Längen änderte sich zugunsten kürzerer, stabilerer Sequenzen, die potenziell neuroprotektiv sind. Selbstverständlich stellt sich bei jeder Genom-Editierung die berechtigte Frage der Sicherheit und möglicher Off-Target Effekte. In umfassenden genomweiten Analysen durch Methoden wie CIRCLE-seq und Hochdurchsatz-Whole-Genome-Sequencing konnte zwar gezeigt werden, dass zahlreiche basen-editierten Stellen im Genom existieren, allerdings fanden sich die meisten Off-Target-Ereignisse in nicht-codierenden oder synonymen Sequenzen, die keine Aminosäureänderungen verursachen. Dies reduziert zwar nicht vollständig die Risiken, spricht aber für eine relativ hohe Spezifität der eingesetzten Editoren im Kontext der repetitiven CAG-Tracks.
Ein weiterer interessanter Aspekt ist die Möglichkeit, durch die Unterbrechung der Repeats die Bildung schädlicher Sekundärstrukturen im DNA-Molekül zu verhindern. G-Quadruplexe oder Hakenartige Haarnadelstrukturen, die bei langen, ununterbrochenen Repeats durch Basenpaarungen entstehen, können reparaturbedingte Fehlprozesse und somit Expansionen fördern. Die Einführung von Unterbrechungen brechen solche Strukturen auf und verbessern die genomische Stabilität. Somit wirken die Basen-Editoren nicht nur auf der Ebene der Nukleotidsequenz, sondern beeinflussen auch die biophysikalischen Eigenschaften der DNA. Diese technischen Fortschritte bieten neue Perspektiven für die Behandlung von Huntington-Krankheit, besonders da der Fokus der bisherigen Therapieansätze meist auf der Verringerung des Mutanten Huntingtin-Proteins lag, etwa durch RNA-Interferenz oder Antisense-Oligonukleotide.
Durch den direkten Eingriff in die Ursache der Repeat-Expansion können möglicherweise dauerhaftere und effektivere Lösungen verfolgt werden. Zukunftsorientierte Forschungen beschäftigen sich zudem damit, wie diese Technologie in unterschiedlichen Zelltypen des Gehirns, wie Neuronen und Gliazellen, effizient eingesetzt werden kann. Zudem ist die Wahl des geeigneten Vektors, der möglichst viele relevante Zellen erreicht und gleichzeitig unerwünschte Immunantworten minimiert, ein entscheidender Faktor. Die AAV9-Serotypen haben sich als besonders geeignet für die effiziente Transduktion von Zellen im zentralen Nervensystem erwiesen. Eine weitere Herausforderung ist das Timing der Behandlung.
Modelle zeigen, dass somatische CAG-Expansionen über Jahrzehnte hinweg langsam zunehmen, bevor eine klinische Symptomatik einsetzt. Die frühe Intervention, möglicherweise bereits in präsymptomatischen Stadien, könnte somit ein wesentliches Ziel sein, um den Verlauf der Krankheit aufzuhalten oder zu verlangsamen. Schließlich sind klinische Studien notwendig, um die gewonnenen Erkenntnisse aus Zellkultur- und Tiermodellen auf ihre Aussagekraft und Sicherheit im Menschen zu überprüfen. Dabei müssen vor allem nachhaltige Editierungserfolge, der Einfluss auf Krankheitsprogression und langfristige Sicherheit im Mittelpunkt stehen. Zusammengefasst leistet die gezielte Einführung von Interruptions mittels Basen-Editoren einen wichtigen Beitrag zur Stabilisierung der Pathologie bei Huntington.
Durch die Reduktion somatischer Repeat-Expansionen in Patienten- und Tiermodellen entsteht für Betroffene erstmals die Hoffnung auf eine genetisch basierte Therapie, die nicht nur Symptome lindert, sondern die molekulare Ursache der Erkrankung nachhaltig adressiert. Die Herausforderung bleibt, diese Erkenntnisse technisch zu optimieren und sicher in die klinische Anwendung zu bringen.