Die Alzheimer-Krankheit (AD) zählt zu den weltweit häufigsten neurodegenerativen Erkrankungen und stellt eine immense medizinische und gesellschaftliche Herausforderung dar. Trotz intensiver Forschung bleiben frühe, präzise Diagnosemethoden und verlässliche Biomarker, die den Krankheitsverlauf vorhersagen können, weiterhin ein zentrales Anliegen. In den letzten Jahren hat die Epigenetik, speziell die DNA-Methylierung, als Indikator biologischen Alters zunehmend das wissenschaftliche Interesse geweckt. Neueste Untersuchungen zeigen, dass das sogenannte epigenetische Alter, insbesondere gemessen im peripheren Blut einer Person, nicht nur die biologische Alterung widerspiegelt, sondern auch eng mit dem Fortschreiten von Alzheimer und kognitiven Abbauprozessen korreliert. Dies eröffnet potenziell neue diagnostische und prognostische Ansätze in der Alzheimerforschung und der klinischen Praxis.
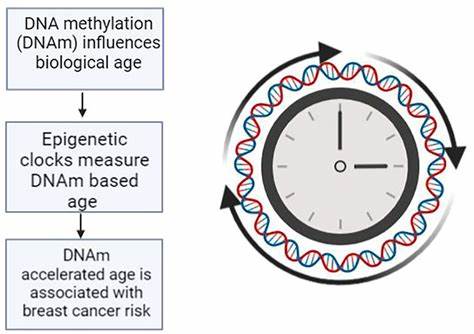
Epigenetisches Alter und DNA-Methylierung – eine Einführung Epigenetik beschreibt Veränderungen an der DNA, die die Genaktivität beeinflussen, ohne die eigentliche DNA-Sequenz zu verändern. Eines der wichtigsten epigenetischen Mechanismen ist die DNA-Methylierung, bei der Methylgruppen an Cytosinbasen der DNA angeheftet werden. Diese Veränderungen entwickeln sich im Laufe des Lebens beeinflusst durch genetische Faktoren, Umwelteinflüsse, Lebensstil und Krankheiten und bilden eine Art biologisches Gedächtnis. Die Auswertung dieser spezifischen DNA-Methylierungsmuster kann zur Schätzung des biologischen Alters – dem sogenannten epigenetischen Alter – genutzt werden. Epigenetische Uhren, die auf der Analyse zahlreicher CpG-Stellen (DNA-Abschnitte) basieren, erlauben eine Abschätzung des biologischen Alters mit hoher Genauigkeit.
Diese Uhren differenzieren sich vom Kalendarium des chronologischen Alters, indem sie Lebensstil, Umweltfaktoren und Gesundheit einbeziehen. Zu den jüngeren und besonders aussagekräftigen Modellen zählen der DNAmPhenoAge- und der DNAmGrimAge-Algorithmus, welche Aspekte von Morbidität und Mortalitätsrisiko in ihre Berechnungen einbeziehen. Zusammenhang zwischen epigenetischem Alter und Alzheimer-Krankheit Die Alzheimer-Krankheit ist charakterisiert durch fortschreitenden neuronalem Verlust, amyloide Plaques, neurofibrilläre Tangles und eine zunehmende kognitive Verschlechterung. Neben genetischen Risikofaktoren rückt die Rolle der biologischen Alterung als treibender Faktor der AD-Pathogenese verstärkt in den Fokus. Hierbei ist das epigenetische Altern ein vielversprechender Biomarker, der eng mit zellulärer Gesundheit, Entzündungsprozessen und neurodegenerativer Progression in Verbindung steht.
Jüngere Studien, die hauptsächlich auf Querschnittsdaten beruhten, konnten bislang nur schwache oder uneinheitliche Assoziationen zwischen epigenetischer Beschleunigung und Alzheimer-Risiko nachweisen. Dies lag unter anderem daran, dass viele Untersuchungen nur einzelne Zeitpunkte betrachteten und sich auf wenige Outcomes beschränkten. Neuere, longitudinal ausgerichtete Studien, wie jene von Bonham et al., nutzen umfangreiche Kohorten mit multimodalen Bildgebungsdaten und validierten epigenetischen Uhren, um die kausalen Zusammenhänge zwischen biologischem Alter und AD besser zu verstehen. Wichtig ist, dass diese Studien zeigen konnten, dass eine beschleunigte epigenetische Alterung im peripheren Blut von Menschen, die zu Studienbeginn kognitiv normal waren, mit einer erhöhten Wahrscheinlichkeit für die Entwicklung von leichter kognitiver Beeinträchtigung (MCI) oder einer vollständig ausgeprägten Alzheimer-Erkrankung einhergehen kann.
Dabei bleibt die Vorhersagekraft des epigenetischen Alters auch nach Berücksichtigung des tatsächlichen kalendarischen Alters erhalten, was die Relevanz der biologischen Alterung als eigenständigen Risikofaktor unterstreicht. Longitudinale Studien und Neuroimaging – neue Einblicke in den Krankheitsverlauf Langzeitstudien mit wiederholter biometrischer und klinischer Erfassung ermöglichen es, Veränderungen der kognitiven Funktionen im Zeitverlauf zu analysieren und mit molekularen und strukturellen Gehirnveränderungen zu verknüpfen. Die Kombination von epigenetischen Messungen mit Bildgebungstechniken wie Magnetresonanztomographie (MRT) ist hierbei besonders aussagekräftig. Dabei wurde festgestellt, dass eine höhere biologische Alterung anhand des DNAmPhenoAge und DNAmGrimAge mit einer stärkeren Ausdünnung der Großhirnrinde (insbesondere in typischen Alzheimer-Regionen wie dem entorhinalen Cortex, dem Parahippocampus und dem Präkunäus) einhergeht. Parallel dazu zeigte sich eine vermehrte Belastung durch weiße Substanzveränderungen im Gehirn, die als White Matter Hyperintensities (WMH) bekannt sind und häufig mit kleinen Gefäßveränderungen und entzündlichen Prozessen in Verbindung gebracht werden.
Diese Kombination aus molekularen und strukturellen Markern ermöglicht eine frühe Identifikation von Personen mit höherem Risiko für den kognitiven Abbau und die Entwicklung von Alzheimer, noch bevor klinische Symptome manifest werden. Neue Perspektiven in der klinischen Anwendung und Forschung Die Möglichkeit, mit einer einfachen Blutprobe das epigenetische Alter zu bestimmen und daraus Risiken für Alzheimerentwicklung und neurodegenerative Vorgänge abzuleiten, könnte die diagnostische Landschaft revolutionieren. Klassische Biomarker wie die Amyloid-PET oder die Liquoruntersuchung sind mit hohen Kosten, invasiven Verfahren und begrenzter Verfügbarkeit verbunden. Die Messung der DNA-Methylierung im peripheren Blut bietet eine kostengünstige, minimal-invasive und leicht zugängliche Alternative. Darüber hinaus können die epigenetischen Alterungsmaße zusätzliche Informationen zu komorbiden Erkrankungen wie Herz-Kreislauf-Erkrankungen liefern, die als unabhängige oder mitwirkende Faktoren für Alzheimer betrachtet werden.
Das ermöglicht eine umfassendere Risikoabschätzung, die über das chronologische Alter hinausgeht. Trotz dieser Fortschritte sind weitere Validierungen in größeren, ethnisch diversen und gut charakterisierten Populationen notwendig. Es gilt außerdem, die epigenetischen Uhren hinsichtlich ihrer Spezifität für Alzheimer gegenüber anderen altersassoziierten Erkrankungen und deren Kombinationsmöglichkeiten mit anderen Biomarkern weiter zu erforschen. Zukunftsaussichten und Implikationen für Prävention und Therapie Wenn epigenetische Alterungsmarker zuverlässig das individuelle Alzheimer-Risiko prognostizieren können, eröffnen sich neue Chancen für personalisierte Präventionsstrategien. Risikopatienten könnten frühzeitig identifiziert werden und gezielte Interventionen, sei es durch Lifestyle-Anpassungen, pharmakologische Maßnahmen oder Monitoring, könnten rechtzeitig eingeleitet werden.