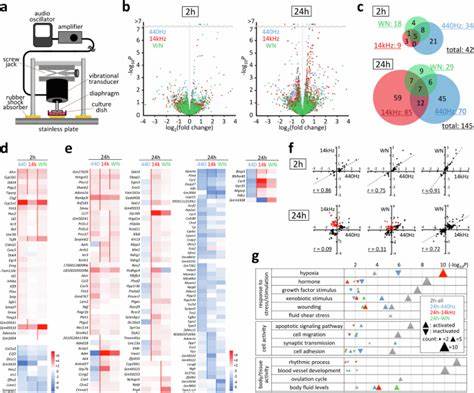
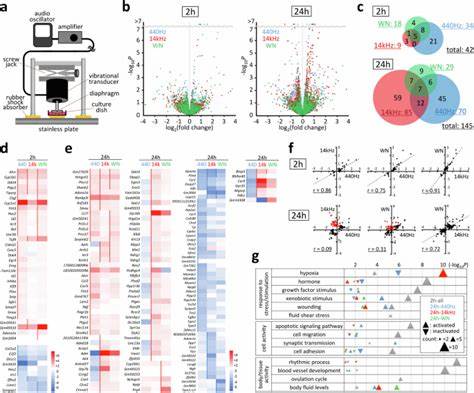
In der heutigen biowissenschaftlichen Forschung gilt die mechanische Stimulation von Zellen als ein essenzieller Faktor zur Regulation vielfältiger zellulärer Prozesse, darunter Proliferation, Differenzierung und Programmierter Zelltod. Während klassische mechanische Reize wie Druck, Zugbelastung und Scherkräfte gut untersucht sind, rückt die Rolle von akustischen Wellen, vor allem im hörbaren Frequenzbereich, zunehmend in den Fokus der Wissenschaft. Die akustische Modulation mechanosensitiver Gene und deren Einfluss auf die Adipozytendifferenzierung bieten spannende neue Perspektiven im Verständnis der zellulären Reaktion auf subtile mechanische Impulse aus der Umwelt und im Körperinneren. Akustische Wellen als mechanische Reize Akustische Wellen sind Druckwellen, die sich durch Materialien ausbreiten und dabei oszillierende Druckänderungen verursachen. Im hörbaren Bereich liegen sie typischerweise zwischen 20 Hertz und 20 Kilohertz.
Im menschlichen Körper, der ein komplexes Medium aus Knochen, Gewebe und Flüssigkeiten darstellt, werden diese Wellen durch verschiedene Strukturen geleitet – sei es durch Knochenleitung oder Gewebeleitung. Dabei entstehen Druckveränderungen in der Zellumgebung, die auf molekularer Ebene durchaus wahrgenommen und verarbeitet werden können. Die Untersuchung von Schallemissionen in Zellkulturen zeigt, dass selbst geringe Schalldrücke im Bereich von einigen hundert Pascal ausreichen, um in Zellen eine signifikante Veränderung der Genexpression hervorzurufen. Der Mechanismus dahinter ist jedoch vielschichtig. Anders als bei physischem Druck oder Zug, der eine statische oder langsam veränderliche Kraft erzeugt, bringen Schallwellen eine hochfrequente, dynamische Kraft mit, die Zellen zu adaptiven Reaktionen zwingt und bestimmte Signalwege fördert oder hemmt.
Mechanosensitive Gene und deren Bedeutung Mechanosensitive Gene kodieren für Proteine, die an der Wahrnehmung und Weiterleitung mechanischer Reize beteiligt sind. Viele dieser Gene spielen eine zentrale Rolle in der Regulation von Zelladhäsion, Migration, Proliferation und Differenzierung. Besonders relevant sind hierbei Gene wie Ptgs2 (Prostaglandin-Endoperoxid-Synthase 2, auch als Cyclooxygenase-2 bekannt) und Ctgf (Connective Tissue Growth Factor), die als Marker für mechanosensitive Reaktionen auf verschiedene physikalische Stimuli gelten. Ptgs2 ist als Schlüsselenzym an der Produktion von Prostaglandin E2 (PGE2) beteiligt, einem Mediator mit vielfältigen biologischen Wirkungen, einschließlich der Regulation von Entzündungsreaktionen und Zellwachstum. Ctgf wiederum ist ein Wachstumsfaktor, der Zelladhäsion und Extrazellulärmatrixinteraktionen moduliert.
Beide Gene werden durch akustische Stimulation beeinflusst, was zeigt, dass Schallwellen tatsächlich biologische Signalwege aktivieren können. Kernmechanismus der akustischen Signaltransduktion Neuere Forschungen legen nahe, dass akustische Signale über die sogenannten Fokalen Adhäsionen in der Zelle wahrgenommen werden. Diese sind komplex strukturierte Proteinkomplexe, die die Außenzellmatrix mit dem Zytoskelett verbinden und als Sensoren mechanischer Kräfte fungieren. Die Aktivierung dieser Adhäsionen führt insbesondere zur Phosphorylierung der Fokal-Adhäsions-Kinase (FAK) an spezifischen Tyrosinresten, was wiederum intrazelluläre Signalwege in Gang setzt, die die Genexpression regulieren. In Experimenten mit murinen Myoblasten konnte gezeigt werden, dass durch direkte Schallemission bei einem Schalldruck von etwa 100 Pascal innerhalb von Stunden eine signifikante Zunahme der Phosphorylierung von FAK an der Position Y397 stattfindet.
Diese Aktivierung ist Voraussetzung für die Hochregulation von Ptgs2 und Ctgf, was die Kaskade einer mechanischen Wahrnehmung bis hin zur Genregulation verdeutlicht. Prostaglandin E2 und seine Rolle in der Differenzierung Die durch Ptgs2 katalysierte Synthese von PGE2 ist ein zentraler Schritt in der akustischen Signalweiterleitung. PGE2 wirkt autokrin und parakrin und kann über den EP4-Rezeptor die Zellantwort modulieren. Insbesondere in der Adipozytendifferenzierung hat PGE2 eine inhibierende Wirkung, welche die Umwandlung von Präadipozyten in reife Fettzellen hemmt. Studien an 3T3-L1-Zellen, einem etablierten Modell für die Adipozytendifferenzierung, zeigen, dass kontinuierliche oder periodische akustische Stimulation die Expression von typischen Adipozyten-Markergenen wie Cebpa und Pparg signifikant reduziert.
Die Unterdrückung dieser Transkriptionsfaktoren korreliert mit einer verminderten Lipidakkumulation und einem erhöhten Anteil an undifferenzierten Zellen nach Differenzierungskulturen mit gleichzeitiger Schallbehandlung. Die direkte Modulation mechanosensitiver Gene durch Schall könnte somit ein vielversprechender Ansatz sein, um die Differenzierung von Fettzellen kontrolliert zu beeinflussen und damit potenziell auch Stoffwechselerkrankungen wie Adipositas oder Diabetes von einer neuen Seite anzugehen. Unterschiede in der Zellantwort und zelltypspezifische Sensitivität Nicht alle Zellen reagieren jedoch in gleicher Weise auf akustische Reize. Die Sensitivität hängt stark vom Zelltyp, der Dichte und dem Zustand der Fokalen Adhäsionen ab. So zeigten stromale Zellen, wie Fibroblasten und präadipöse Zelllinien, besonders ausgeprägte Reaktionen in Form von FAK-Phosphorylierung und Ptgs2-Expression.
Epitheliale und neuronale Zelllinien hingegen reagierten deutlich schwächer oder gar nicht. Dieses heterogene Antwortverhalten ist auf die unterschiedlichen mechanischen Eigenschaften und Funktionen der jeweiligen Zellen zurückzuführen: bewegliche und adhäsionsstarke Zellen besitzen in der Regel stärker ausgeprägte und dynamische Fokale Adhäsionen und sind dadurch empfänglicher für mechanische Reize jeglicher Art. Praktische Implikationen und zukünftige Perspektiven Die Erkenntnis, dass akustische Wellen in physiologisch relevanten Intensitäten direkte zelluläre Signalwege aktivieren und Gene modulieren können, eröffnet mannigfaltige Anwendungsmöglichkeiten. In der Gewebezüchtung und regenerativen Medizin könnten gezielt akustische Stimuli eingesetzt werden, um Zellverhalten zu steuern und Gewebeneubildung zu fördern oder zu hemmen. Darüber hinaus könnte die akustische Steuerung der Adipozytendifferenzierung neue Therapieansätze gegen Übergewicht und metabolische Syndrome inspirieren.
Durch die gezielte Beeinflussung mechanosensitiver Signalwege mittels kontrollierter Schallfrequenzen und -intensitäten ließen sich möglicherweise biologische Prozesse im Fettgewebe modifizieren, ohne auf pharmakologische Mittel zurückgreifen zu müssen. Allerdings sind weitere Forschungen nötig, um die molekularen Details und Wechselwirkungen vollständig zu verstehen. So könnte es neben dem identifizierten FAK-Ptgs2-PGE2-Weg weitere Signalwege geben, die durch akustische Reize aktiviert werden. Zudem ist zu klären, wie sich unterschiedliche Frequenzen, Intensitäten und Schallwellenformen auf verschiedene Zelltypen und biologische Prozesse auswirken. Technologische Fortschritte in der Schallerzeugung und Kontrollmechanismen ermöglichen mittlerweile präzise akustische Stimulationen im Labor.
Ein besseres Verständnis der Zellantworten wird es erlauben, maßgeschneiderte akustische Behandlungsprotokolle zu entwickeln, die sowohl In-vitro als auch In-vivo erfolgreich eingesetzt werden können. Fazit Die Modulation mechanosensitiver Gene durch akustische Stimulation stellt einen faszinierenden Schnittpunkt zwischen Physik, Zellbiologie und Medizin dar. Durch die dynamische Übertragung mechanischer Schallwellen können Zellen auf subtile, aber dennoch wirkungsvolle Weise in ihrer Genexpression und Funktion beeinflusst werden. Besonders im Kontext der Adipozytendifferenzierung zeigen sich deutliche Effekte, die therapeutisches Potenzial bergen. Diese Erkenntnisse erweitern unser Verständnis der Rolle von physikalischen Kräften in biologischen Systemen und laden zu interdisziplinären Forschungen ein.
Akustische Wellen als nicht-invasive, steuerbare Stimuli könnten zukünftig zu einem innovativen Werkzeug in der Zellsteuerung und Medizin werden, was neue Wege in der Behandlung und Prävention von Erkrankungen eröffnet.