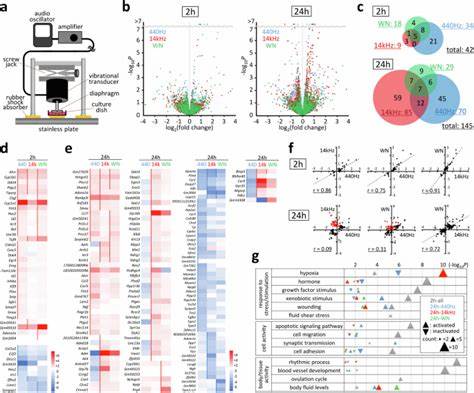
Die Bedeutung mechanosensitiver Gene in der Zellbiologie ist unbestritten. Sie spielen eine entscheidende Rolle bei der Wahrnehmung und Verarbeitung mechanischer Reize in Zellen, was wiederum fundamentale Zellprozesse beeinflusst. In jüngster Zeit hat sich ein neues Forschungsfeld entwickelt, das untersucht, wie akustische Signale – insbesondere Schallwellen im hörbaren Bereich – mechanosensitive Genantworten modulieren und damit die Differenzierung von Zellen beeinflussen können. Deep Dive-Studien zeigen, dass die akustische Stimulation nicht nur passive Umwelteinflüsse darstellt, sondern aktiv als zellulärer Stimulus wirkt, der komplexe molekulare Prozesse in Gang setzt. Dieses Wissen kann wegweisend sein für neue biotechnologische Methoden, regenerative Medizin sowie die Entwicklung innovativer Therapien zur Beeinflussung von Gewebeentwicklung und Zellverhalten.
Die Forschung zu mechanosensitiven Genen hat bisher vor allem physikalische Reize wie Druck, Zug, Scherkräfte und Steifigkeit des Substrats untersucht. Dabei werden solche Kräfte von spezifischen molekularen Sensoren wahrgenommen, die typischerweise in Membrankanälen, dem Zytoskelett sowie in der Zell-Adhäsion verankert sind. Die so ausgelösten Signalwege können Zellteilung, Zelldifferenzierung, Migration und Apoptose steuern. Allerdings wurde die Wirkung von akustischen Reizen auf zelluläre Gene bislang nur wenig betrachtet, obwohl Schall als mechanisches Wellensystem eine natürliche und allgegenwärtige physikalische Kraft darstellt. In aktuellen Experimenten wurde eine direkte Sound-Emissionsanlage entwickelt, die Schallwellen mit definierter Frequenz und Intensität gezielt auf Zellkulturen überträgt.
Murine Myoblasten der Zelllinie C2C12 wurden unter Einwirkung von Schall im Bereich von einigen hundert Pascal intensiv untersucht. Die akustische Stimulation erfolgte mit Sinuswellen unterschiedlicher Frequenzen im hörbaren Bereich sowie Weißrauschen. Nach 2 und 24 Stunden waren hochsignifikante Veränderungen im Expressionsmuster verschiedenster Gene nachweisbar. Interessanterweise reagierten viele dieser Gene auf die Schallreize in Abhängigkeit von Frequenz, Intensität und sogar der Wellenform des akustischen Signals unterschiedlich. Insbesondere Gene, die für mechanosensitive Funktionen bekannt sind, wie Ptgs2 (Cyclooxygenase-2) und Ctgf (Connective Tissue Growth Factor), zeigten deutliche klangabhängige Aktivierung oder Hemmung.
Diese akustisch induzierten genetischen Veränderungen wurden durch Aktivierung von Signalwegen vermittelt, die unmittelbar mit zellulären Mechanotransduktionssystemen verbunden sind. Die Fokal-Aderns-Kinase (FAK), ein zentrales Protein in der Vernetzung von Zellmembran und Zytoskelett, wurde als erster Trigger dieser Kaskade identifiziert. Durch Phosphorylierung von Y397 wurde FAK aktiviert, was zur Nachfolgereaktion in der Produktion von Prostaglandin E2 (PGE2) führte – einem bioaktiven Lipid, das zahlreiche zelluläre Prozesse moduliert. Die Freisetzung von PGE2 nach akustischer Stimulation zeigte, dass diese Signalketten nicht nur kurzfristige Veränderungen, sondern auch nachhaltige Effekte auf die Zellpopulation haben können. Dadurch wird beispielsweise die Expression zahlreicher downstream Gene reguliert, die an Mechanotransduktion, Zellmigration, Apoptose und Lebenszyklusprozessen beteiligt sind.
Die Wirkung des PGE2 auf Rezeptoren wie EP4 wurde experimentell belegt, indem pharmakologische Inhibitoren entsprechende Effekte blockierten. Eine bemerkenswerte Entdeckung war die besonders kräftige Reaktion von Adipozyten-Vorläufern, wie der 3T3-L1 Zelllinie, auf die akustische Stimulation. Die Differenzierung dieser präadipösen Zellen zu reifen Fettzellen konnte durch kontinuierliche oder periodische Schallwellen signifikant unterdrückt werden. Dabei ging die Expression der adipogenen Marker Gene Cebpa und Pparg deutlich zurück, was sich auch in der geringeren Lipidakkumulation in den Kulturen widerspiegelte. Die Schallwellen erzeugten somit eine Hemmung der Fettzellreifung, die in ihrer Stärke mit der beim Zusatz hoher PGE2-Konzentrationen vergleichbar war.
Diese Entdeckung eröffnet faszinierende Perspektiven für die biomedizinische Praxis und Grundwissenschaft. Akustische Stimulation stellt eine nicht-invasive und präzise Methode dar, die Zellbiologie zu beeinflussen und möglicherweise therapeutisch zu nutzen. Speziell kann die Kontrolle von Fettzellen, die für metabolische Erkrankungen wie Adipositas und Diabetes von zentraler Bedeutung sind, durch gezielte Soundwellen neu gedacht werden. Ebenso könnten regenerative Prozesse durch Anpassung der mechanosensitiven Signalwege stimuliert oder gehemmt werden. Die mechanistische Erklärung für diese Ergebnisse beruht auf der Fähigkeit der Zellen, akustische Wellen als mechanische Kräfte wahrzunehmen.
Diese mechanische Energie überträgt sich über fokale Adhäsionen auf das Zytoskelett und löst eine Signalkaskade aus. Die lokale Fluidbewegung im Medium, welche mit der akustischen Stimulation einhergeht, scheint je nach Frequenz unterschiedliche biochemische Reaktionen zu provozieren, wodurch auch eine differenzierte Genexpression erklärt wird. Niedrige Frequenzen wie 440 Hz erzeugten stärkere Strömungen und damit andere mechanische Reize als höhere Frequenzen um 14 kHz, die weniger Fluss, aber möglicherweise andere Frequenzsignale transportieren. Zahlreiche Zelltypen unterscheiden sich in ihrer Empfindlichkeit gegenüber akustischer Stimulation. Adhesive und mobile Zelltypen mit ausgeprägten fokalen Adhäsionen zeigten stärkere Reaktionen, während weniger adhäsive Zellen wie Epithelzellen oder neuroblastische Zelllinien schwach oder gar nicht auf Schallimpulse reagierten.
Das weist auf eine zelltypspezifische Biomimetik mit differenzierter Nutzung des akustischen Signals hin und bietet Ansatzpunkte für zielgerichtete Behandlungen und biotechnologische Anwendungsszenarien. Die Ergebnisse dieses Forschungsbereichs ergänzen die bisherigen Erkenntnisse zu mechanischen Stimuli wie Druck, Scherkräften oder Ultraschall, erweitern jedoch das Spektrum auf hörbare Schallfrequenzen mit deutlich niedrigeren Energiewerten. Somit öffnet sich ein neues Kapitel in der Zellbiologie, das einerseits tiefer die Natur mechanosensitiver Signalwege erklärt und andererseits das Potenzial hat, innovative Werkzeuge für die Zellmanipulation anzubieten. Abschließend ist festzuhalten, dass akustische Wellen in physiologischen Intensitäten eine bisher unterschätzte Kraftquelle für die Regulation genetischer Programme darstellen. Ihre Fähigkeit, die Differenzierung von Adipozyten zu unterdrücken, kann dabei konkrete medizinische Relevanz besitzen.
Zukünftige Studien werden noch genauer die Signaltransduktionswege kartieren, Frequenz- und Intensitätsschwellen bestimmen und die Langzeiteffekte auf Gewebeebene untersuchen. Die Möglichkeiten der akustischen Modulation im Leben umfassen nicht nur Therapie und Diagnostik, sondern auch die Entwicklung biohybrider Systeme, in denen Schall als „Steuerelement“ für zelluläre Funktionen dient. Die universelle Natur von Schall macht dieses Konzept besonders attraktiv für interdisziplinäre Verfahren, von Tissue Engineering bis zur adaptiven Biotechnologie. Insgesamt zeigt sich, dass die akustische Modulation mechanosensitiver Gene und die daraus resultierende Beeinflussung der Adipozytendifferenzierung ein faszinierendes neues Forschungsfeld darstellt, das sowohl die fundamentale Zellbiologie als auch die angewandte Biomedizin nachhaltig beeinflussen wird.