Alzheimer zählt zu den am meisten gefürchteten neurodegenerativen Erkrankungen unserer Zeit und stellt sowohl für Betroffene als auch das Gesundheitssystem weltweit eine enorme Herausforderung dar. Obwohl im Laufe der Jahrzehnte Fortschritte bei der Diagnostik gemacht wurden, bleibt die Früherkennung und zuverlässige Vorhersage des Krankheitsverlaufs ein schwieriges Unterfangen. Im Zentrum der aktuellen Forschung steht das epigenetische Alter, welches sich anhand von DNA-Methylierungsmustern im Blut bestimmt lässt. Neue Studien zeigen, dass die Messung des epigenetischen Alters aus peripherem Blut nicht nur einen Zusammenhang mit dem Auftreten von Alzheimer aufweist, sondern auch den Fortschritt der Erkrankung vorhersagen kann. Diese Erkenntnisse versprechen innovative Ansätze für Diagnostik, Prävention und individualisierte Therapie.
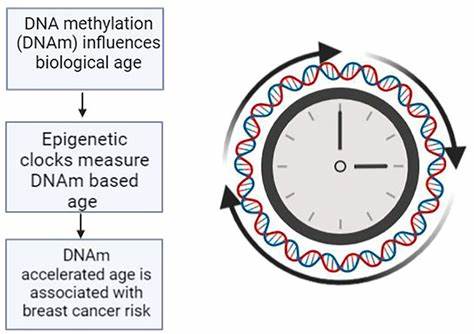
Das Konzept des epigenetischen Alters beruht darauf, dass biologische Alterungsprozesse sich nicht nur auf das reine Kalenderalter beziehen. Vielmehr verändern sich Ausprägungen von DNA-Methylierung im Verlauf des Lebens durch genetische Faktoren, Umwelteinflüsse und Krankheiten. DNA-Methylierung beschreibt eine biochemische Modifikation, bei der Methylgruppen an DNA-Basen angeheftet werden – ein Mechanismus, der die Genaktivität reguliert ohne die genetische Sequenz zu verändern. Diese Veränderungen sind messbar und entwickelten sich zu hochsensiblen Biomarkern zur Einschätzung des biologischen Alters, das als epigenetisches Alter bezeichnet wird. Die Differenz zwischen epigenetischem und chronologischem Alter, die sogenannte epigenetische Alterungsbeschleunigung, bietet tieferen Einblick in den Zustand des Organismus und seine Anfälligkeit gegenüber altersassoziierten Erkrankungen.
Im Rahmen der Alzheimer-Forschung reifte die Hypothese, dass epigenetische Veränderungen eine zentrale Rolle in der Pathophysiologie spielen. Untersuchungen an Mäusemodellen sowie an menschlichem Hirngewebe belegten, dass bei Alzheimer-Patienten charakteristische DNA-Methylierungsmuster auftreten, die sich von normaler altersbedingter Veränderung unterscheiden. Diese epigenetischen Veränderungen könnten Schlüsselprozesse des neuronalen Abbaus und der kognitiven Funktionsverluste erklären. Jedoch zeigte sich in klinischen Studien mit Blutproben bisher ein widersprüchliches Bild. Während einige cross-sektionale Studien keinerlei klare Zusammenhänge zwischen epigenetischem Alter und Erkrankungsrisiko fanden, signalisierten einige kleinere Untersuchungen einen vielversprechenden Zusammenhang.
Diese Diskrepanzen resultieren vor allem daraus, dass viele Untersuchungen nur Momentaufnahmen erfassten und auf unterschiedliche epigenetische Uhrmodelle zurückgriffen. Jüngste Studien nahmen hingegen eine umfassende Herangehensweise mittels longitudinaler Analysen und multimodaler neuroimaging-Methoden vor. Dabei wurden insbesondere zwei sogenannte zweite Generationen von epigenetischen Uhren herangezogen: DNAmPhenoAge und DNAmGrimAge. Diese gehören zu den fortschrittlichsten Modellen, da sie multifaktorielle biologische Alterungsprozesse abbilden, welche über reines chronologisches Alter hinausgehen. Die Studie untersuchte über einen längeren Zeitraum hinweg 403 Teilnehmer aus der Alzheimer Disease Neuroimaging Initiative (ADNI), überwiegend kognitiv normale ältere Erwachsene, Menschen mit leichter kognitiver Beeinträchtigung (MCI) und Patienten mit manifestem Alzheimer.
Die Ergebnisse zeigten eindrucksvoll, dass ein beschleunigtes epigenetisches Alter, insbesondere gemessen mit DNAmPhenoAge, signifikant mit dem Fortschreiten von kognitivem Normalzustand zu MCI oder Alzheimer verbunden ist. Dies wurde durch sogenannte Cox-Proportional-Hazard-Modelle bestätigt und blieb auch nach Korrektur für das tatsächliche Lebensalter bestehen. Interessanterweise war die Assoziation für DNAmGrimAge zwar vorhanden, jedoch etwas schwächer. Zusätzlich bewiesen die Daten, dass das epigenetische Alter vor dem klinischen Auftreten von Symptomen Hinweise auf einen ungünstigen kognitiven Verlauf liefern kann. Für verschiedene kognitive Tests wie den Clinical Dementia Rating Scale Sum of Boxes (CDR-SB), den Montreal Cognitive Assessment (MoCA) und den Mini-Mental-State-Examination (MMSE) zeigte sich, dass erhöhte epigenetische Alterung mit rascheren Verschlechterungen korreliert.
Neben den klinisch-kognitiven Daten wurden neuroimaging-Methoden verwendet, um strukturelle Veränderungen im Gehirn zu quantifizieren. Hier konnten Beschleunigungen im epigenetischen Alter mit corticaler Atrophie, also einer Ausdünnung der Kortikalis in AD-typischen Hirnregionen, wie beispielsweise dem entorhinalen Kortex und dem fusiformen Gyrus, assoziiert werden. Gleichzeitig korrelierte epigenetische Alterung mit einem erhöhten Volumen von weißen Hirnsubstanzenveränderungen (White Matter Hyperintensities, WMH), die häufig bei Alzheimer und anderen vaskulären Hirnerkrankungen auftreten. Diese Befunde unterstreichen den starken neurodegenerativen Zusammenhang epigenetisch gemessener biologischer Alterung auf zerebraler Ebene. Die stärksten Zusammenhänge zwischen epigenetischer Alterung und kortikaler Dicke fanden sich vor allem bei kognitiv normaler und MCI-gruppierten Probanden, während die Assoziation mit weißen Substanzveränderungen besonders im manifesten Alzheimer verstärkt auftrat.
Dieser Befund lässt auf unterschiedliche pathophysiologische Stadien und mögliche Wirkmechanismen schließen, da WMH oft mit vaskulären Komorbiditäten verknüpft sind, die sich im späteren Verlauf der Erkrankung entfalten. Darüber hinaus verdeutlichen die Daten, dass epigenetisches Alter allein chronologisches Alter nicht vollständig ersetzt, sondern ergänzend einen unabhängig wichtigen Biomarker darstellt. Die Vorteile der Erfassung epigenetischer Alterungsmarker im Blut liegen auf der Hand. Im Vergleich zu aufwendigen und teuren Verfahren wie Positronen-Emissions-Tomographie (PET) zur Amyloid-Plaque-Abbildung oder invasiven Liquoranalysen bietet die Blutbasierte Messung eine relative Leichtigkeit, Kosteneffizienz und geringe Belastung für die Patient:innen. Damit eröffnet sich das Potenzial für breit angelegte Screenings im Frühstadium, um Hochrisikopersonen zu identifizieren und frühzeitig Interventionen einzuleiten.
Darüber hinaus liefern die gegenwärtigen Erkenntnisse neue Impulse für die Diagnose und Verlaufsbeobachtung der Alzheimer-Erkrankung. Die Kombination aus epigenetischem Alter, neurokognitiven Tests und strukturellen Hirnbildgebungsverfahren verspricht ein integriertes und genaues Bild des biologischen Zustands, das den subjektiv ermittelten klinischen Diagnosen überlegen ist. Dies könnte in Zukunft individualisierte Therapiestrategien ermöglichen, bei denen beispielsweise Menschen mit auffälliger epigenetischer Alterung intensiver überwacht oder mit gezielten Maßnahmen behandelt werden. Trotz der vielversprechenden Resultate gibt es wichtige Einschränkungen und offene Fragen. So beschränkten sich die vorliegenden Untersuchungen auf zwei epigenetische Uhren aus der zweiten Generation und verwendeten hauptsächlich Daten aus einer Kohorte.
Die Übertragbarkeit auf andere Populationen, ethnische Gruppen oder Patienten mit komorbiden Erkrankungen ist noch zu überprüfen. Ebenso müssen zukünftige Studien die Dynamik des epigenetischen Alters im Zeitverlauf beleuchten, um besser zu verstehen, wie Interventionen es beeinflussen könnten. Außerdem ist das periphere Blut nur ein indirekter Indikator für Hirngewebeveränderungen. Während Korrelationen zwischen Blut- und Hirngewebe-Methylierung bestehen, ist nicht jede epigenetische Modifikation im Blut ein Spiegelbild der Gehirnalterung. Dennoch könnten periphere Mechanismen wie Immunfunktion und vaskuläre Gesundheit wichtige parakline Indikatoren für den neurodegenerativen Prozess sein.
Die im Fokus stehenden epigenetischen Uhren differenzieren sich hinsichtlich ihrer Konstruktion und biologischen Interpretation. DNAmPhenoAge ist eher auf die allgemeine Lebensspanne und gesundliches Altern ausgelegt, während DNAmGrimAge verstärkt Mortalitätsrisiken und externe Faktoren wie Raucherstatus integriert. Die unterschiedliche Assoziation dieser Uhren mit kognitiven Ergebnissen bzw. neuroimaging-Biomarkern deutet auf komplementäre Informationen hin, die für klinische Anwendungen nutzbar gemacht werden könnten. Die Integration epigenetischer Altersschätzungen in die Alzheimer-Forschung markiert einen Paradigmenwechsel hin zu einer tiefergehenden biologischen Betrachtung von Alterungsprozessen, die über chronologisches Alter hinausgehen.