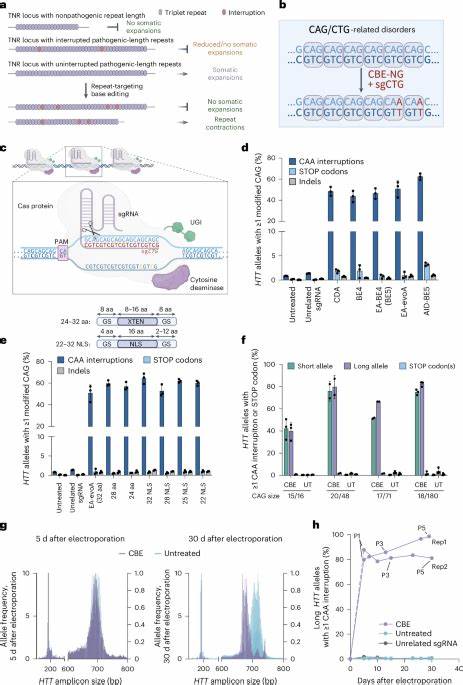
Huntington ist eine der bekanntesten genetischen Erkrankungen, die durch eine pathologische Ausdehnung von trinukleotidischen Wiederholungen im HTT-Gen verursacht wird. Diese sogenannten CAG-Wiederholungen im Genom führen dazu, dass sich das Protein Huntingtin in einer toxischen Form ansammelt, die Nervenzellen schädigt und eine fortschreitende neurodegenerative Erkrankung auslöst. Die Dynamik und Instabilität dieser Wiederholungen, insbesondere somatische Erweiterungen, beeinflussen den frühen Beginn und die Schwere der Erkrankung maßgeblich. In den letzten Jahren hat sich die Forschung vermehrt darauf konzentriert, Wege zu finden, um diese instabilen Repeat-Strukturen zu stabilisieren und somit den Verlauf der Krankheit zu verlangsamen oder sogar zu stoppen. Jüngste Studien setzen hierbei auf gezielte genomische Basen-Editierung, um synonyme oder sogenannte „Interruptions“ in die CAG-Repeats einzufügen.
Diese Unterbrechungen in der Wiederholungssequenz können die DNA-Struktur stabilisieren, die Entstehung von hochordentlichen sekundären Strukturen verhindern und damit somatische Repeat-Erweiterungen reduzieren. Besonders vielversprechend sind dabei cytosin- und adeninbasierte Editoren, welche einzelne Nukleotide gezielt verändern, ohne Doppelstrangbrüche im DNA-Molekül zu verursachen. Dies reduziert das Risiko unerwünschter Nebenwirkungen und ermöglicht eine schonendere Modifikation der Zielsequenz. In vitro Experimente mit Patientenzellen zeigen eindrucksvoll, dass der Einsatz von Cytosin-Basen-Editoren (CBEs) die CAG-Wiederholung im Huntingtin-Gen gezielt anreichert mit CAA-Interruptions. Diese synonyme Kodon-Variation bewirkt, dass sich die proteinogene Sequenz nicht ändert, jedoch die genomische Stabilität deutlich steigt und die typischen somatischen Expansionsraten signifikant abnehmen.
Diese sorgsam eingefügten Interruptions ähneln natürlichen Varianten, die epidemiologisch mit einem verzögerten Krankheitsausbruch assoziiert sind. Die Anwendung dieser Methoden in humanen Huntington-Fibroblasten zeigte eine deutliche Abnahme der Expansion von langen CAG-Trakten über Zellpassagen hinweg. Parallel dazu konnten in Tiermodellen, insbesondere in Htt.Q111 Mäusen, vielversprechende Fortschritte erzielt werden. Die In-vivo-Verabreichung von Adeno-assoziierten Viren (AAVs), welche genetische Konstrukte für Basen-Editoren in das zentrale Nervensystem bringen, führten zu einer effizienten und zielgerichteten Einführung von CAA-Interruptions in Huntingtin-Allele der Gehirnzellen.
Dadurch wurde eine signifikante Verminderung der somatischen CAG-Expansionsrate im Striatum und Cortex beobachtet, den Hirnregionen, die von Huntington besonders betroffen sind. Besonders beeindruckend ist, dass die Behandlung nicht nur die Expansionen verhinderte, sondern auch teilweise eine Kontraktion der Repeat-Längen unterstützte. Längere CAG-Repeat gelten als besonders toxisch, sodass eine Verkürzung im genomischen Kontext einen therapeutischen Mehrwert darstellt. Die Off-Target-Aktivitäten dieser Basen-Editoren wurden mittels modernster Genome-weiten Verfahren wie CIRCLE-seq und Hochdurchsatzsequenzierung sorgfältig untersucht. Die Resultate zeigen, dass trotz der Vielzahl potenzieller unverhältnismäßiger Zielsequenzen durch das repetitive Genom nur begrenzte und überwiegend harmlose Veränderungen in nicht-kodierenden oder durch Synonyme abgepufferten Regionen auftreten.
Dieses Sicherheitsprofil erinnert an natürliche polypeptidische Variation und begünstigt die weitere klinische Entwicklung dieser Technologie. Neben der Cytosin-basierenden Editierung zeigt auch adeniner Basen-Editing großes Potenzial für verwandte Erkrankungen mit trinukleotidischen Wiederholungen, wie zum Beispiel der Friedreich-Ataxie, welche durch GAA-Repeat Expansionen im FXN-Gen gekennzeichnet ist. Hier konnten ABEs Interruptions-Sequenzen in Patientenzellen und entsprechenden Mausmodellen gezielt einfügen, was zur Reduktion der Repeat-Expansion beitrug und eine teilweise Wiederherstellung der Genexpression ermöglichte. Ähnlich wie bei Huntington zeigt die genetische Variation mit Interruptions eine bessere Stabilität und milde Phänotypen, was die therapeutische Strategie stützt. Trotz der beeindruckenden Fortschritte gibt es noch Herausforderungen zu bewältigen.
Die präzise Ansteuerung der Wiederholungstrakte, die Vermeidung von ungewollten Mutationen und das Erreichen therapeutisch relevanter Effizienz in verschiedenen Zelltypen und Geweben gehören dazu. Auch sind die Langzeitfolgen einer permanenten Basen-Editor-Expression noch nicht vollständig verstanden, weshalb alternative transient wirkende Komponenten oder neuronenspezifische Expression erforscht werden. Ebenso ist die Verabreichung an erwachsene Patientinnen und Patienten und die Wirkung auf bereits ausgeprägte Hirnschäden ein zu prüfender Aspekt. In der Gesamtschau markieren die aktuellen Studien einen Paradigmenwechsel im Umgang mit Huntington und verwandten TNR-Erkrankungen. Die gezielte Funktionsmodifikation im Genom, welche die natürliche Variation nachahmt und somit somatische Instabilitäten verhindert, könnte den Weg in eine dauerhafte Therapie ebnen.
Durch die Kombination aus molekularer Präzision, guter Sicherheitsbewertung und nachgewiesener Wirksamkeit in Patientenzellen sowie Tiermodellen ist ein finales therapeutisches Konzept in greifbare Nähe gerückt. Die Bedeutung dieser Forschung erstreckt sich über Huntington hinaus auf eine Vielzahl neurodegenerativer Erkrankungen mit ähnlichen molekularen Ursachen. Die Erkenntnisse zum Einfluss von Interruptions auf Repeat-Stabilität eröffnen neue Diagnostik- und Präventionsansätze, die bereits bestehende Kenntnisse über genetische Modifier ergänzen und vertiefen. Ausblickend wird die kontinuierliche Weiterentwicklung der Genome-Editing-Technologien, verbunden mit optimierten Lieferungssystemen und präklinischen Modellanalysen, den Schritt in klinische Studien unterstützen. Dabei wird es essenziell sein, die molekularen Mechanismen somatischer Repeat-Erweiterungen noch besser zu verstehen, um Interventionen zum richtigen Zeitpunkt im Krankheitsverlauf zu etablieren.
Die erfolgreiche Umsetzung könnte nicht nur das Leben vieler Huntington-Patienten verbessern, sondern auch als Blaupause für andere genetische Erkrankungen dienen. Zusammenfassend repräsentiert die gezielte Basen-Editierung der TNR-Wiederholungen eine innovative und vielversprechende therapeutische Strategie gegen Huntington. Durch die gezielte Einführung von Interruptions in die CAG-Repeat Sequenzen gelingt es, die somatische Expansion einzudämmen, die genomische Stabilität zu erhöhen und so das Fortschreiten der Krankheit potenziell zu verzögern oder zu verhindert. Diese Fortschritte eröffnen neue Perspektiven für die Behandlung einer bislang unheilbaren neurodegenerativen Erkrankung und stellen einen bedeutenden Meilenstein auf dem Weg zur personalisierten Genomtherapie dar.