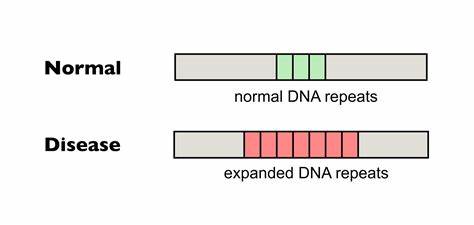
Die Huntington-Krankheit (HD) ist eine verheerende neurodegenerative Erkrankung, die durch eine Expansion von CAG-Trinukleotidwiederholungen im HTT-Gen verursacht wird. Diese sogenannte trinukleotidale Repeat-Expansion führt zu einer pathologischen Verlängerung des Polyglutamin-Abschnitts im Huntingtin-Protein, was letztlich zu neuronaler Schädigung und den charakteristischen Symptomen wie Bewegungsstörungen, kognitivem Verfall und psychischen Symptomen führt. Die Forschung rund um die molekularen Mechanismen und potenzielle Therapieansätze hat in den letzten Jahren bedeutende Fortschritte gemacht, insbesondere auf dem Gebiet der Gen-Editierung. Im Fokus steht dabei die Fähigkeit, somatische Repeat-Expansionen zu reduzieren, die als Treiber der Erkrankungsschwere und des Krankheitsverlaufs gelten. Somatische Repeat-Expansionen bei Huntington Bei Menschen mit Huntington ist die Anzahl der CAG-Wiederholungen bei Geburt eine wichtige Determinante für den Krankheitsausbruch und die Progression.
Allerdings sind diese Repeat-Sequenzen nicht statisch, sondern weisen eine dynamische Instabilität auf, die zur weiteren Expansion im Somagewebe während des Lebens führt. Besonders betroffen ist das zentrale Nervensystem, wo sich die Repeat-Trakte im Verlauf der Zeit verlängern. Diese somatischen Expansionen korrelieren mit einem schnelleren Fortschreiten der Symptome und einer verschlechterten Prognose. Die Instabilität wird durch komplexe DNA- und RNA-Strukturveränderungen, wie zelluläre Haarpin-Formationen und R-Loops, sowie durch Fehler in DNA-Reparaturprozessen hervorgerufen. Da die somatische Expansion eine wichtige Rolle in der Pathogenese spielt, besteht der therapeutische Ansatz darin, die Stabilität der Repeat-Trakte zu verbessern und damit das Fortschreiten der Krankheit aufzuhalten oder zumindest zu verlangsamen.
Interventionen auf DNA-Ebene könnten die Expansion verhindern oder sogar rückgängig machen. Gen-Editierung mittels Base Editing Eine neue, vielversprechende Technologie zur gezielten Manipulation genetischer Informationen ist das sogenannte Base Editing. Anders als klassische CRISPR/Cas9-Systeme, die DNA-Doppelstrangbrüche induzieren, ermöglichen Base Editor eine präzise Änderung einzelner Basenpaare, ohne dabei direkte Brüche zu verursachen. Für Huntington wurde vor allem die Umsetzung cytosin- und adeninbasierter Editoren erforscht, welche C•G nach T•A beziehungsweise A•T nach G•C substituieren können. Diese Technologie wird genutzt, um gezielt sogenannte Interruptionsbasen in den CAG-Repeat-Trakt einzuführen.
Solche Interruptions haben sich in natürlichen humanen Allelen als stabilisierend erwiesen. Beispielsweise sind einzelne CAA-Codons innerhalb des CAG-Trakts in bestimmten Familien vorhanden und verzögern den Ausbruch der Krankheit beträchtlich. Die Idee ist, durch Base Editing gezielt diese synonymeren CAA-Unterbrechungen zu erzeugen und so die Repeat-Expansion zu dämpfen. Wissenschaftliche Fortschritte in Zellkulturen In vitro-Studien mit Patientenfibroblasten konnten erfolgreich zeigen, dass die Anwendung von cytosinbasierenden Editoren gezielt CAG-Repeats in der HTT-Gensequenz mit CAA-Interruptions modifizieren kann. Die Experimente belegen, dass nach der Behandlung somatische Expansionen verlangsamt oder sogar rückgängig gemacht werden.
Über mehrere Zellpassagen hinweg bleiben die Einfügungen der Interruptionsbasen stabil und führen zu einer insgesamt kürzeren CAG-Repeatlänge, was eine Verringerung der toxischen Proteinaggregation bedeuten könnte. Diese Veränderungen gehen einher mit einer erhöhten genetischen Stabilität und zeigen kein signifikantes zelluläres Toxizitätsprofil, was die Machbarkeit und Sicherheit dieses Ansatzes unterstreicht. Zudem konnte eine höhere Effizienz in längeren krankheitsassoziierten Repeatlängen festgestellt werden, was besonders relevant für die Huntington-Krankheit ist, da über die Zeit anwachsende Repeat-Längen problematisch sind. Erfolge in tierischen Modellen Um die Wirksamkeit der Base Editing-Therapie auch in vivo zu testen, wurden in den letzten Jahren Modellsysteme wie der Htt.Q111-Maus entwickelt, welche humane längere CAG-Repeats im HTT-Gen tragen und eine ähnliche somatische Expansion wie bei Patienten aufweisen.
Die Verabreichung von Adeno-assoziierten Viren (AAVs), welche den Base Editor in die zentralnervösen Gewebe transportieren, führte in diesen Modellen zu einem signifikanten Einbau von Interruptionsbasen und einer Verringerung der somatischen Repeat-Expansion in zielgerichteten Bereichen wie Cortex und Striatum. Zu beobachten war nicht nur das Stoppen des weiteren Wachstums der Repeat-Länge, sondern sogar eine teilweise Kontraktion bestehender Repeat-Trakte. Dieses entscheidende Ergebnis zeigt, dass eine therapeutische Intervention nach Auftreten der Erkrankungssymptome weiterhin potenziell von Nutzen sein kann. Sicherheit und Off-Target-Effekte Ein häufiger Kritikpunkt bei Gen-Editierung ist das Risiko von Off-Target-Editierungen, also unbeabsichtigten Änderungen an anderen genomischen Stellen. Umfassende Analysen mittels CIRCLE-seq und Ganzgenomsequenzierung in Zellkulturen haben gezeigt, dass die Base Editing-Strategien überwiegend hochspezifisch sind.
Größtenteils treten Off-Target-Änderungen in nicht-kodierenden Bereichen auf und führen meist zu stillen oder harmlosen Mutationen. Nur ein kleiner Prozentsatz der Off-Target-Ereignisse betrifft protein-kodierende Regionen und diese Veränderungen sind in der Regel benign. Entwicklungsarbeiten konzentrieren sich daher darauf, alternative Enzymvarianten mit reduzierter Nebenaktivität zu entwickeln oder die Base Editor-Dosis präzise zu dosieren. Ausblick und klinische Relevanz Die Basen-Editierung von trinukleotidalen Repeat-Trakten repräsentiert einen neuartigen therapeutischen Ansatz mit Potenzial, nicht nur die Progression der Huntington-Krankheit zu verlangsamen, sondern womöglich auch die Krankheitsauslösung auf genetischer Ebene zu verhindern. Zusammengefasst deuten die Forschungen auf eine durch Interruptions erzielte genomische Stabilisierung hin, die in Patienten fibroblastischen und tierexperimentellen Modellen funktioniert.
Langfristig werden fortgeschrittene Liefermethoden und Editor-Varianten erforderlich sein, die eine sichere, effiziente und neuronenspezifische Abgabe ermöglichen. Klinische Studien müssen noch zeigen, dass die genetischen Veränderungen in menschlichen Patienten therapieübergreifend und offensichtlich mit verbesserter Lebensqualität korrelieren. Die adressierten Verfahren könnten zudem für weitere neurodegenerative Krankheiten mit Repeat-Expansionen angepasst werden. Fazit Die Verhinderung und Umkehrung somatischer Repeat-Expansionen durch präzise Gen-Editierung ist ein bedeutender Durchbruch in der Huntington-Krankheit Forschung. Die verkürzte, unterbrechungsreiche Repeat-Sequenz kann die DNA-Struktur stabilisieren und somit pathogene Verlängerungen verhindern.
Neuartige Base Editing-Technologien zeigen, dass individuelle Basen als Interruptionscodons effizient eingeführt werden können – sowohl in Zellkulturen als auch in Tiermodellen, mit minimalen Nebeneffekten. Dies eröffnet Perspektiven für eine gezielte Gentherapie, die den Krankheitsverlauf signifikant verbessern oder sogar dauerhaft aufhalten kann. Die aktuellen Ergebnisse bilden eine solide Basis für die Entwicklung zukünftiger klinischer Anwendungen und spiegeln den rasanten Fortschritt in der personalisierten genetischen Medizin für Huntington wider.