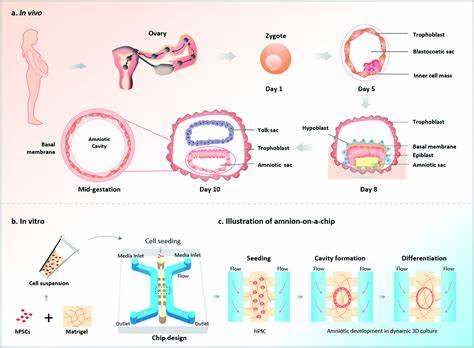
Die Forschung im Bereich der menschlichen Embryonalentwicklung hat einen bedeutenden Fortschritt erzielt: Wissenschaftler des renommierten Francis Crick Instituts haben ein neues Stammzellmodell entwickelt, das die Entstehung und Entwicklung des menschlichen Amnionsacks detailgetreu nachbildet. Dieses Modell ermöglicht es Forschern, tiefergehende Einblicke in eine der kritischsten Phasen der Entwicklung zwischen zwei und vier Wochen nach der Befruchtung zu gewinnen. Damit wird ein Bereich studierbar, der aufgrund ethischer und technischer Einschränkungen bislang weitestgehend im Dunkeln lag. Der Amnionsack, auch als Amnion bezeichnet, ist eine schützende Membran, die einen flüssigkeitsgefüllten Sack formt, in dem sich der Embryo während der frühen Entwicklungsstadien befindet. Lange Zeit galt seine Hauptfunktion lediglich darin, den Embryo zu umhüllen, vor mechanischen Stößen zu schützen und nährstoffreiche Flüssigkeiten bereitzustellen, noch bevor sich die Plazenta vollständig bildet.
Doch das neue Modell eröffnet faszinierende Perspektiven: Der Amnionsack könnte weit mehr als ein passiver Schutzmechanismus sein. Er könnte aktiv mit embryonalen Zellen kommunizieren und deren Entwicklung beeinflussen. Das eigens entwickelte 3D-Modell, genannt post-gastrulation amnioid (PGA), simuliert die Struktur und Funktion des Amnionsacks nach dem sogenannten Gastrulationsprozess. Während der Gastrulation ordnen sich embryonale Zellen in spezifischen Schichten an, aus denen später unterschiedliche Gewebe und Organe entstehen. Bislang fehlte jedoch ein humanbezogenes Modell, um genauere Einblicke in die Organisation und Entwicklung nach diesem Zeitpunkt zu erhalten, da der Einsatz menschlicher Embryonen ab dem 14.
Tag aus ethischen Gründen untersagt ist. Die Wissenschaftler kultivierten menschliche embryonale Stammzellen unter kontrollierten Bedingungen und steuerten das Zellverhalten mit nur zwei chemischen Signalen über 48 Stunden. So gelang es den Zellen, sich selbstständig in zwei charakteristische Zellschichten zu organisieren: die innere Schicht der Amnion-Endodermzellen und eine äußere Schicht aus extraembryonalem Mesoderm. Bereits am zehnten Tag bildeten über 90 Prozent der PGAs eine sac-ähnliche Struktur, die im Verlauf von 90 Tagen kontinuierlich an Größe zunahm, ohne dass zusätzliche Signale nötig waren. Die Zusammensetzung der Zellen entsprach erstaunlich genau der des echten menschlichen Amnionsacks, und die darin enthaltene Flüssigkeit ähnelte sowohl in Bezug auf Zusammensetzung als auch Funktion der natürlichen Fruchtwasserflüssigkeit.
Besonders interessant sind die Erkenntnisse zur Rolle des Transkriptionsfaktors GATA3. Dieses Protein, das an der Regulation und Aktivierung verschiedener Gene beteiligt ist, wurde als Schlüsselfaktor für die Entwicklung des Amniongewebes identifiziert. Durch gezielte Abschaltung von GATA3 in den PGAs beobachteten die Forscher ein deutlich beeinträchtigtes Wachstum der Amnionzellen. Andererseits führte eine Überexpression von GATA3 dazu, dass embryonale Stammzellen selbständig Amnionsack-ähnliche Strukturen ausbildeten, ohne weitere externe Signale. Diese Experimente verdeutlichen, dass GATA3 notwendig ist, um den Entwicklungsvorgang des Amnions in Gang zu setzen.
Darüber hinaus konnten die Wissenschaftler beobachten, wie der Amnionsack nicht nur Schutz bietet, sondern aktiv mit anderen embryonalen Zellen kommuniziert. Indem sie PGA-Zellen mit unbehandelten embryonalen Stammzellen kombinierten, gelang es, neue Amnionsack-ähnliche Strukturen zu induzieren. Dies weist darauf hin, dass Signale aus dem Amnion eine wichtige Rolle bei der Spezifizierung und Reifung embryonaler Zellen spielen könnten. Dieses neue Verständnis könnte die bisherige Sichtweise revolutionieren, in der der Amnion hauptsächlich als passive Schutzbarriere betrachtet wurde. Die medizinischen Implikationen dieses Durchbruchs sind immens.
Die Amnionmembran besitzt regenerative, anti-entzündliche und antimikrobielle Eigenschaften und wird bereits in verschiedenen klinischen Bereichen eingesetzt. Beispielsweise wird sie für die Rekonstruktion der Hornhaut, zur Behandlung von Verbrennungen, Ulzera oder bei der Reparatur der Gebärmutterschleimhaut verwendet. Allerdings ist die Verfügbarkeit von Spendergewebe begrenzt und stark von Geburten per Kaiserschnitt abhängig. Die Entwicklung der PGAs eröffnet hier eine innovative Alternative: Es könnte künftig möglich sein, Amnionmembranen aus den eigenen Zellen eines Patienten zu züchten. Dies würde nicht nur ethische Probleme bei der Gewinnung menschlicher Gewebe lösen, sondern auch die Versorgung mit Amnionmembranen skalierbar, reproduzierbar und kosteneffizient gestalten.
Das Forschungsteam arbeitet bereits gemeinsam mit der Abteilung für Translation am Francis Crick Institut daran, die Anwendungsmöglichkeiten der PGAs in der klinischen Praxis weiter zu erforschen und zu optimieren. Parallel dazu werden die molekularen Mechanismen der Kommunikation zwischen Amnion und embryonalen Zellen weiter entschlüsselt, um die früheren Entwicklungsstadien des Menschen noch besser zu verstehen. Die Forscher unterstreichen, dass diese bahnbrechende Arbeit dank enger Zusammenarbeit mit den Genomik-, Metabolomik- und Proteomik-Abteilungen möglich wurde. Solche interdisziplinären Synergien ermöglichen es, ein tiefgreifendes Bild von der Entstehung und Funktion des Amnions zu zeichnen. Der Seniorautor und Laborleiter Silvia Santos betont, dass die menschliche Frühentwicklung aufgrund ethischer und technischer Einschränkungen bisher wie eine „Black Box“ war.
Das neu entwickelte Modell verschaffe erstmals Sichtbarkeit in einem für die Entwicklung kritischen Zeitraum ohne den Einsatz menschlicher Embryonen. Es verändert grundlegend die Rolle, die der Amnion zukünftig zugeschrieben wird: weg vom bloßen Schutz hin zu einer aktiven, kommunikativen Rolle im embryonalen Entwicklungsprozess. Für Borzo Gharibi, den Erstautor der Studie, markiert die Entwicklung der PGAs einen Wendepunkt: Ursprünglich habe man die Zellidentitätsbildung im Embryo erforschen wollen, doch das Projekt nahm eine überraschende Wendung mit der Entstehung eines Modells, das die komplexen Strukturen und Funktionen des menschlichen Amnionsacks mit hoher Genauigkeit und Reproduzierbarkeit nachbildet. Dieses Werkzeug öffnet Türen für tiefergehende Untersuchungen und bietet eine Basis für zukünftige wissenschaftliche und medizinische Fortschritte. Die Entdeckung und Modellierung des menschlichen Amnionsacks eröffnet neue Forschungsfelder und entwickelt zugleich praktische Anwendungen, die das Potenzial haben, die regenerative Medizin und klinische Therapien nachhaltig zu verändern.
Über die klinische Nutzung hinaus könnte das Verständnis der Bedeutung des Amnions für die Embryonalentwicklung dabei helfen, angeborene Entwicklungsstörungen besser zu verstehen und möglicherweise präventiv zu behandeln. Die gewonnene Erkenntnis, dass der Amnion aktiv mit dem Embryo kommuniziert, fordert eine Neubewertung der biologischen Prozesse in der Frühphase der menschlichen Entwicklung. Diese Sichtweise könnte in Zukunft auch Auswirkungen auf Bereiche wie die Reproduktionsmedizin und die künstliche Befruchtung haben, indem sie neue Ansätze bietet, um die Gesundheit und Entwicklung von Embryonen zu optimieren. Zusammenfassend lässt sich sagen, dass das innovative PGA-Stammzellmodell einen wichtigen Meilenstein für die Biowissenschaften darstellt. Es kombiniert moderne Stammzelltechnologie mit genetischer Manipulation und zellulärer Analyse, um eine bisher unerreichte Detailtiefe in die Entwicklung des Amnions und damit des frühen Menschen zu ermöglichen.
Der wissenschaftliche Fortschritt bringt nicht nur neues Wissen, sondern auch Hoffnung für neue Heilmethoden und Therapien zum Schutz von Leben schon in seinen ersten Tagen.