Die HIV-Pandemie bleibt eine der größten Herausforderungen der modernen Medizin, obwohl antiretrovirale Therapien (ART) das Leben vieler Betroffener deutlich verbessert haben. Eine der größten Hürden zur Heilung von HIV ist die Tatsache, dass sich Viren in einem sogenannten latenten Zustand in ruhenden CD4+ T-Zellen verstecken. In diesem latenten Reservoir ruht das Virus, vermehrt sich nicht und entgeht so dem Zugriff des Immunsystems oder antiretroviraler Medikamente. Deshalb besteht ein fortwährendes Risiko der viralen Reaktivierung, sobald Therapien unterbrochen werden. Die Suche nach Methoden, um diese latente HIV-Infektion gezielt zu reaktivieren und somit aus den Verstecken zu holen, ist ein zentrales Ziel der HIV-Forschung.
Die jüngsten Fortschritte bei der Nutzung von mRNA-Technologien und Lipid-Nanopartikeln (LNPs) prägen einen neuen, vielversprechenden Ansatz in diesem Bereich. Ruhephasen von T-Zellen stellen eine besondere Herausforderung dar, wenn es darum geht, molekulare Wirkstoffe zu liefern. Herkömmliche Methoden zur Transfektion von T-Zellen, insbesondere wenn diese nicht voraktiviert sind, stoßen an ihre Grenzen. Viele Technologien versagen darin, mRNA effizient in ruhende T-Zellen zu bringen, ohne dabei Zelltoxizität oder ungewollte Zellaktivierung auszulösen. Aus diesem Grund wollen Forscher sichere, effiziente und präzise Wege zur mRNA-Lieferung entwickeln, die speziell auf die Eigenschaften ruhender CD4+ T-Zellen zugeschnitten sind.
Eine neu entwickelte LNP-Formulierung, bezeichnet als LNP X, eröffnet hier völlig neue Möglichkeiten. Die Kombination eines ionisierbaren Lipids namens SM-102 mit dem natürlich vorkommenden Cholesterin-Analogon β-Sitosterol verbessert die Fähigkeit der Nanopartikel, mRNA in ruhende T-Zellen einzuschleusen. Diese Formulierung ermöglicht eine bisher unerreichte Transfektionseffizienz von über 75 % bei ruhenden, nicht aktivierten T-Zellen, ohne dabei deren Überlebensrate zu beeinträchtigen oder Zellaktivierungsmarker zu erhöhen. Dies stellt einen bedeutenden Fortschritt dar, da frühere LNP-Formulierungen, etwa die aus Patisiran bekannte klassische Zusammensetzung, nur minimale Effizienz bei ruhenden T-Zellen zeigen. Das Besondere an LNP X ist nicht nur die erhöhte Zellassoziation, also wie gut die Nanopartikel an die Zelloberfläche binden und aufgenommen werden, sondern auch eine verbesserte Effizienz in der Translation der gelieferten mRNA im Zytosol.
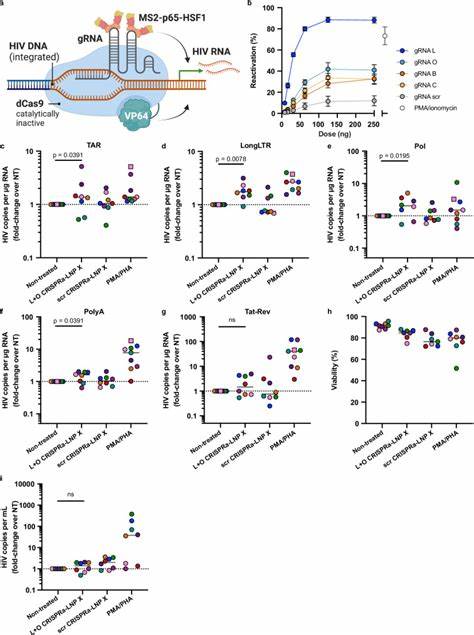
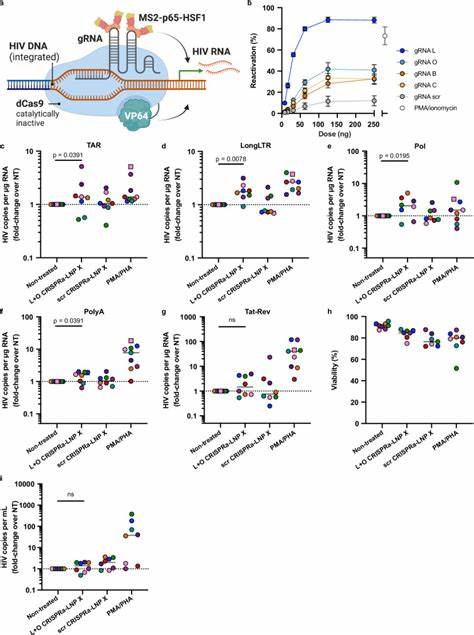
Studien haben gezeigt, dass der Unterschied in der Wirksamkeit nicht primär auf der verbesserten Freisetzung von mRNA aus Endosomen basiert, sondern auf einer anschließenden Steigerung der Proteinbiosynthese innerhalb der Zelle. Diese Erkenntnis bietet spannende Einblicke in die Mechanismen der mRNA-Translation und könnte weitreichende Auswirkungen für zukünftige mRNA-Therapeutika haben, die auf schwer zugängliche Zelltypen abzielen. Mit LNP X wurde eine mRNA codiert, die für das HIV-Tat-Protein codiert, eine Schlüsselkomponente für die Aktivierung der HIV-Transkription. Tat fungiert als Trans-aktivator, indem es an die TAR-Elemente des HIV-Langterminal-Repeats bindet und somit die Prozessivität der RNA-Polymerase II erhöht. Die resultierende Verbesserung der Transkription ermöglicht den Ausbruch aus der Latenz.
In zellkulturellen Modellen, einschließlich J-Lat-Zellen, die ein Modell für latente HIV-Infektion sind, konnte die Tat-mRNA in LNP X deutlich stärker exprimiert werden als mit früheren Methoden. Dies führte zu einer eindeutigen Aktivierung des latenten Virus, sichtbar durch Reporterproteine, ohne Toxizität oder unerwünschte Aktivierung der T-Zellen selbst. Die Übertragbarkeit dieser Ergebnisse auf primäre T-Zellen von Menschen, die unter ART leben, wurde durch ex-vivo Studien bestätigt. Die Behandlung von ruhenden CD4+ T-Zellen mit Tat-LNP X zeigte eine beeindruckende und konsequente Reaktivierung von HIV-Transkripten, inklusive vollständig gespleißter Formen von Tat-Rev RNA, ein entscheidender Schritt zur Produktion neuer infektiöser Viren. Noch bemerkenswerter ist, dass diese Transkriptionsaktivierung diejenige übertraf, die durch allgemeine T-Zell-Aktivierung mit starken Mitogenen wie PMA und PHA erzielt wird.
Gleichzeitig blieb eine unerwünschte Zellaktivierung aus, was mögliche entzündliche Nebenwirkungen minimieren könnte. Diese Spezifität der Aktivierung ist besonders bedeutsam, da viele bisherige Latenz-reaktivierende Agenzien (LRAs) breite zelluläre Signalwege aktiviert haben, was zu unerwünschten Effekten, wie der Hemmung von Immunfunktionen, führte. Die mRNA-basierte Tat-LNP-X-Strategie zielt direkt auf das HIV-Genom ab und umgeht somit viele unerwünschte Nebeneffekte. Zudem zeigte die Behandlung eine Erhöhung von HIV-RNA im Zellüberstand, also Ausscheidung von Virenpartikeln, was auf eine funktionelle Reaktivierung hindeutet. Darüber hinaus konnte LNP X größere, komplexere mRNA-Konstrukte wie das CRISPRa-System erfolgreich in ruhende T-Zellen einbringen.
CRISPRa (CRISPR-Aktivator) nutzt eine katalytisch inaktive Cas9 (dCas9), gekoppelt an Transkriptionsaktivator-Domänen wie VP64, um gezielt die Transkription eines Zielgens zu erhöhen. Dabei unterstützt ein modifizierter Guide-RNA-Ansatz die Rekrutierung von weiteren Aktivatoren (p65, HSF1), die synergistisch wirken. Die Ko-Transfektion dieser komplexen RNA-Bestandteile ist eine technische Herausforderung, die mit LNP X erfolgreich gemeistert wurde. Die Funktionalität wurde bestätigt, indem CRISPRa-LNPs, die auf das Endogene Gen IL2RA (CD25) zielten, nachweislich dessen Expression in ruhenden T-Zellen erhöhten, ohne generelle Zellaktivierung zu provozieren. Gezielte Aktivierung des HIV-LTR mit CRISPRa-LNP X wurde ebenfalls getestet.
Spezifisch entworfene Guide RNAs, die an verschiedene Regionen des HIV-Promotors binden, führten zu einer Aktivierung der HIV-Transkription in latenten T-Zellen aus Menschen unter ART. Obwohl die Effizienz der Aktivierung im Vergleich zur Tat-mRNA etwas geringer war, zeigte der Ansatz das Potenzial für eine spezifische und kontrollierte Latenz-Umkehr, die auf genetischer Aktivierungsebene ansetzt und möglicherweise mit weiteren Therapiestrategien kombiniert werden kann. Ein weiteres entscheidendes Thema ist die mangelnde Induktion von Zelltoxizität oder unerwünschten immunologischen Aktivierungen durch LNP X. Sowohl Tat- als auch CRISPRa-LNP-Behandlungen verursachten keine signifikanten Veränderungen in der Expression von Aktivierungsmarkern wie CD25, CD69 oder HLA-DR. Dieses Fehlen von unspezifischer Aktivierung ist ein großer Vorteil gegenüber klassischen LRAs, die oft systemische Nebenwirkungen auslösen.
Die aktuelle Forschung zeigt allerdings, dass alleinige Reaktivierung der latenten HIV-Reservoire durch Tat oder CRISPRa nicht unmittelbar zur Eliminierung latenter Infektionen ausreicht. Verglichen mit frühen Hoffnungen scheinen latente Zellen in hohem Maße resistent gegenüber Virus-vermitteltem Zelltod. Studien deuten darauf hin, dass diese Zellen anti-apoptotische Signaturen aufweisen und daher selbst nach Reaktivierung überleben. Dies verdeutlicht die Notwendigkeit kombinierter Ansätze, die Latenzumkehr mit gezielter Eliminierung dieser Zellen verbinden, etwa durch Immuntherapien, zelluläre Effektormechanismen oder zusätzliche pharmakologische Interventionen. Die Anwendung von LNP X-Technologie in vivo stellt noch Herausforderungen dar.
Es sind weiterführende Untersuchungen nötig, die Immunogenität, Verteilung im Körper, Dauer der mRNA-Präsenz und optimale Dosierung erforschen. Erste klinische Erfahrungen mit LNP-basierten mRNA-Therapeutika, wie Impfstoffen gegen COVID-19 oder der siRNA-basierten Behandlung von Amyloidosen, zeigen jedoch bereits, dass diese Mittel sicher anwendbar sind und eine breite therapeutische Basis bieten. Durch künftige gezielte Ligand-Anpassungen könnte LNP X zudem speziell auf T-Zellen ausgerichtet werden, um die Wirksamkeit weiter zu erhöhen und Nebenwirkungen zu minimieren. Zusammenfassend eröffnet die Entwicklung der neuartigen LNP-X-Plattform eine zukunftsträchtige Perspektive für die Behandlung latenter HIV-Infektionen. Die Möglichkeit, ruhende CD4+ T-Zellen effizient und selektiv zu transfezieren und HIV-spezifische Latency-Reversing Agents, wie HIV-Tat oder CRISPRa, sicher zu liefern, stellt einen Paradigmenwechsel dar.
Während weitere Untersuchungen nötig sind, um Kombinationstherapien zu etablieren, bildet diese Technologie eine wichtige Grundlage auf dem Weg zur Heilung von HIV. Die Fortschritte im Bereich der mRNA-Nanopartikel inspirieren eine Vielzahl weiterer Anwendungen, von der immunonkologischen Therapie bis hin zu seltenen genetischen Erkrankungen, und positionieren LNP X als vielseitiges Werkzeug für die nächste Generation regenerativer und antiviraler Therapien. Für Menschen mit HIV bedeutet dies die Hoffnung auf wirksamere Therapien, die letztlich zu einem dauerhaften Rückgang oder gar zur Eliminierung der Infektion führen können.