Die Bekämpfung und Heilung von HIV (Humanes Immundefizienz-Virus) stellt Wissenschaftler weltweit seit Jahrzehnten vor enorme Herausforderungen. Obwohl antiretrovirale Therapien (ART) den aktiven Viruspartikel stark unterdrücken und die Lebensqualität Betroffener signifikant verbessern können, gelingt es bislang nicht, die Infektion vollständig zu eliminieren. Hauptgrund dafür ist das latente HIV-Reservoir in ruhenden CD4+ T-Zellen, in denen das Virus über Jahre still verankert bleibt und erst bei reaktivierender Aktivität wieder zu einer Virusreplikation führt. Die latente Infektion macht HIV zu einer chronischen Erkrankung, bei der lebenslange medikamentöse Behandlung notwendig ist. Fortschritte in der mRNA-Technologie und innovativen Lipid-Nanopartikel (LNP)-Zustellungssystemen eröffnen jetzt neue Möglichkeiten, gezielt in ruhende T-Zellen einzudringen und die latente Infektion zu aktivieren – ein bedeutender Schritt Richtung potenzieller Heilung.
Die latente Infektion von HIV in CD4+ T-Zellen ist durch das Schweigen viraler Gene charakterisiert. Das Virus integriert sein genetisches Material in das Genom der Wirtszelle, bleibt aber in einem inaktiven Zustand, der keine Virusproteine oder neue Viruspartikel produziert. Diese Latenz schützt das Virus vor Erkennung durch das Immunsystem und Antiretrovirale Medikamente, welche ihre Wirkung hauptsächlich gegen replizierende Viren entfalten. Ein zentrales Ziel aktueller Forschungen ist daher das gezielte Anheben dieses Ruhemodus, um Viren „sichtbar“ zu machen und anschließend zu eliminieren, eine Strategie, die als "Shock and Kill" bezeichnet wird. Traditionelle latenzaufhebende Wirkstoffe (Latency Reversing Agents, LRA) wie Histondeacetylase-Inhibitoren oder andere kleine Moleküle konnten bislang zwar die Transkription des Virus ansatzweise aktivieren, blieben aber therapeutisch ineffektiv, da sie nur geringe Wirkung auf das vollständige Transkriptions- und Translationsprogramm des Virus entfalten.
Hinzu kommt, dass diese Wirkstoffe oft unspezifisch agieren und T-Zellen oder andere Immunzellen aktivieren, was unerwünschte Nebenwirkungen und eine Beeinträchtigung der Immunfunktion hervorrufen kann. Darüber hinaus etablieren latente Viren mehrere Blockaden in Schritte der Transkriptionsverlängerung, Prozessierung und Splicing, die durch diese Wirkstoffe nicht überwunden werden. Für das Erreichen eines HIV-Heilungskonzepts ist daher eine gezieltere und effektivere Latenzaufhebung erforderlich. Ein vielversprechender Durchbruch in diesem Bereich ist die Verwendung von mRNA, die in Lipid-Nanopartikeln verpackt wird, um direkt in ruhende CD4+ T-Zellen eingesetzt zu werden. Hierbei sorgt die mRNA für die Expression spezifischer viraler Proteine, die das HIV-Genom effizient reaktivieren können, ohne die T-Zellen zu aktivieren oder zu schädigen.
Eingebettet in einen optimierten LNP-Träger, der speziell für die Aufnahme durch nicht-aktivierte T-Zellen entwickelt wurde, verbessert diese Technologie die zelluläre Aufnahme und Proteinsynthese dramatisch. Forschungsgruppen haben eine neuartige LNP-Formulierung (LNP X) entworfen, die durch den Austausch des Ionisierbaren Lipids MC3 gegen SM-102 und der Substitution von Cholesterin durch ß-Sitosterol maßgebliche Fortschritte bei der mRNA-Zellaufnahme ohne Aktivierung der T-Zellen ermöglichte. Diese Kombination verbessert die Bindung der Nanopartikel an die Zellmembran und optimiert die Translation der freigesetzten mRNA in der Zelle, wobei die Effizienz der Endosomenentweichung im Vergleich zu älteren Formulierungen unverändert blieb. Der Vorteil liegt jedoch darin, dass mehr mRNA in der Zelle genutzt wird, um das gewünschte Protein zu produzieren – ein effektiverer Einsatz des therapeutischen Wirkstoffs. Zentrales therapeutisches Ziel ist das HIV-Protein Tat, das eine essenzielle Rolle als Transkriptionsaktivator des viralen Genoms übernimmt.
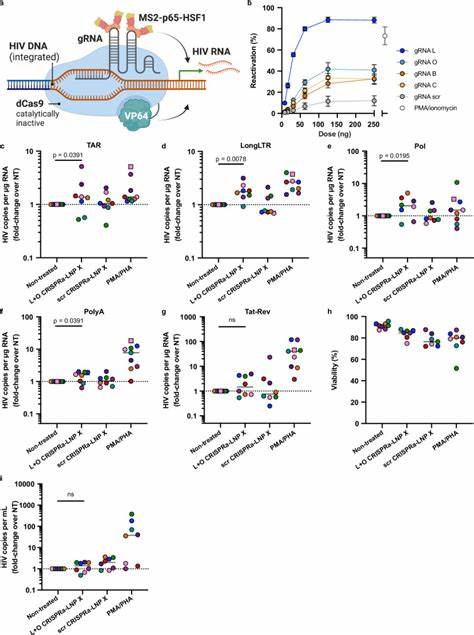
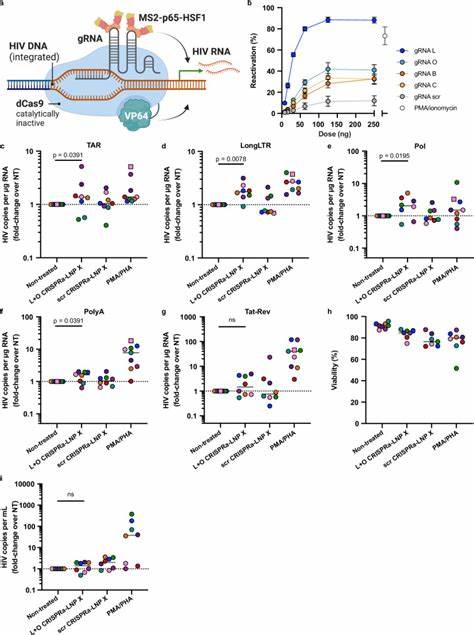
HIV Tat bindet an eine RNA-Struktur namens TAR (Transaktivationsantwort-Element) und fördert die Verlängerung der HIV-RNA während der Transkription. Durch die mRNA-vermittelte Expression von Tat in ruhenden CD4+ T-Zellen mittels LNP X kann die vollständige Aktivierung der latenten Viren erreicht werden. Untersuchungen zeigen, dass Tat-LNP X die Expression verschiedener HIV-RNA-Spezies über Initiation, Verlängerung, Splicing bis zur Produktionsfertigstellung der viralen Transkripte drastisch erhöht – und dies in einer potenteren Weise als mit herkömmlichen immunstimulierenden Mitogenen, jedoch ohne die unerwünschte Aktivierung der T-Zellen selbst. Neben der Reaktivierung durch Tat kann LNP X auch zur Lieferung hochkomplexer CRISPR-basierter Systeme genutzt werden. Das CRISPR-dCas9-Synergistische Aktivator-System (CRISPRa) ist in der Lage, gezielt genomische Promotorbereiche des HIV-Provirus zu aktivieren.
Dabei führt ein ‚toter‘ Cas9 (dCas9) Komplex, gekoppelt mit Transkriptionsverstärkern wie VP64 und weiteren Aktivator-Proteinen, die Expression latent vorhandener HIV-Gene herbei, wobei die Bindung durch Leit-RNAs (gRNAs) exakt an den HIV LTR-Bereich erfolgt. Die Technologie erlaubt eine hochspezifische und flexible Zielsteuerung, die minimale Off-Target-Effekte in den Wirtszellgenen zur Folge hat. Durch Optimierungen in der mRNA-Verabreichung mittels LNP X gelingt es erstmals, diese großer Codierungs-RNAs zusammen mit den notwendigen gRNAs in ruhende CD4+ T-Zellen einzuschleusen und dort die Endogenexpression der Zielgene zu induzieren – ein Meilenstein im Bereich der nukleinsäurebasierten Therapie. Experimente mit CRISPRa-LNP X, die auf die HIV LTR-Promotorregion abzielen, belegen die Aktivierung viral-transkriptioneller Schritte in ex vivo behandelten CD4+ T-Zellen von HIV-infizierten Menschen unter ART. Auch wenn die Aktivierung durch CRISPRa bisher etwas geringer war als bei Tat-LNP X, bietet sie durch die präzise Zielsteuerung ohne allgemeine T-Zell-Aktivierung eine sehr vielversprechende Alternative oder Ergänzung zu herkömmlichen LRA.
Diese Methode könnte zudem weiter verfeinert werden, um eine optimale HIV-Latenz-Aktivierung zu erzielen. Trotz des Fortschritts bleibt eine Herausforderung bestehen: Die alleinige Reaktivierung latenter Viren reicht nicht aus, um das Reservoir an infizierten Zellen signifikant zu reduzieren. Latent infizierte Zellen zeigen eine Resistenz gegenüber dem Virus-induzierten Zelltod und entfalten Überlebensmechanismen. Deshalb müssen kombinierte Therapieansätze, die Latenz-Reaktivierung mit der Erhöhung der cytotoxischen Wirkung oder der Verstärkung der Immunantwort gegen infizierte Zellen verbinden, entwickelt werden. Beispiele solcher ergänzenden Maßnahmen umfassen die Inhibition anti-apoptotischer Proteine wie BCL-2, Verbesserung der Effektivität zytotoxischer T-Zellen oder natürliche Killerzellen, sowie Strategien zur direkten Entfernung des Provirus durch genetische Editierung.
Die hohe Transfektionseffizienz und geringe Toxizität von LNP X zeigen erstmals, dass eine passive, nicht-invasive mRNA-LNP-Technologie für ruhende T-Zellen mit therapeutischem Mehrwert existiert. Diese Methode könnte zukünftig die bisher oft eingesetzten Nucleofektions- oder viralen Vektoren ersetzen, die in der Regel zellstressig sind und nur eine geringe Transfektionsrate in ruhenden T-Zellen gewährleisten. Außerdem eröffnet LNP X die Tür für mRNA-basierte Therapien bei einer Reihe von Erkrankungen, die T-Zellen involvieren – von Immunstörungen bis hin zu Krebsimmuntherapien. Ein weiterer wichtiger Vorteil der mRNA-LNP-Technologie liegt in ihrer modularen und anpassbaren Natur. Je nach Ziel kann die Kapselung verschiedener mRNAs, gRNAs und anderer RNA-Therapeutika in ein gemeinsames LNP-System erfolgen.
Die schnelle Synthese und Optimierung von mRNA ermöglicht dabei eine flexible, patienten- oder indikationsspezifische Behandlung. Wichtig bleibt jedoch die Erforschung der in vivo-Verteilung, Immunogenität und thermischen Stabilität solcher präzise formulierten LNPs, um eine klinische Translation zu ermöglichen. Die Erforschung von LNP X für HIV-Therapeutika ist ein vielversprechender Schritt hin zu einem funktionellen oder sogar sterilierenden HIV-Heilmittel. Obwohl die beschriebenen Studien zunächst ex vivo an Zellkulturen und isolierten T-Zellen durchgeführt wurden, bilden sie die Grundlage für weiterführende in vivo-Studien und klinische Tests. Die Kombination von Latenzaufhebung mit Strategien zur Eliminierung des Reservoirs, unterstützt durch die Präzision und Effizienz hochentwickelter mRNA-Delivery-Systeme wie LNP X, stellt eine der zukunftsträchtigsten Maßnahmen dar, um den jahrzehntelangen Kampf gegen HIV zu revolutionieren.
Zusammenfassend liefert die effiziente mRNA-Lieferung mittels innovativer Lipid-Nanopartikel-Technologien einen faszinierenden, neuen Ansatz, um latente HIV-Infektionen in ruhenden T-Zellen zu reaktivieren. Die spezifische Nutzung von viralen Transkriptionsproteinen wie Tat und die gezielte Genaktivierung durch CRISPRa eröffnen neben der klassischen medikamentösen Therapie völlig neue Möglichkeiten, das latente HIV-Reservoir therapeutisch anzugreifen. Diese Technologien könnten nicht nur die Behandlung von HIV nachhaltig verändern, sondern auch das Potenzial weiter stärken, RNA-basierte Therapien für zahlreiche andere Erkrankungen zu entwickeln und in die klinische Praxis zu bringen.