Die Herausforderung, HIV zu heilen, bleibt eine der größten medizinischen Aufgaben unserer Zeit. Trotz bahnbrechender Fortschritte in der antiretroviralen Therapie (ART), die eine bemerkenswerte Kontrolle der Viruslast ermöglicht, verweilt das Virus in einem latenten Zustand, verborgen in ruhenden CD4+ T-Zellen. Diese sogenannte HIV-Latenz bildet eine unsichtbare Barriere, die bisher alle Versuche einer vollständigen Heilung vereitelte. Neueste Forschungen zeigen jedoch, dass die effiziente Übertragung von mRNA in diese ruhenden T-Zellen ein entscheidender Schritt sein könnte, um die Latenz zu durchbrechen und die verborgenen Viren zu reaktivieren. So kann gezielt das latente Virus entlarvt und anschließend eliminiert werden – ein Ansatz, der das Potenzial eines radikalen Wandels in der HIV-Therapie birgt.
Die HIV-Latenz – ein unsichtbarer Feind In Ruhephasen versteckt sich HIV in bestimmten Immunzellen, vor allem in den CD4+ T-Zellen, und verbleibt dort in einem inaktiven, integrierten Zustand im menschlichen Genom. Hierdurch entgeht das Virus nicht nur der Immunüberwachung, sondern auch der Wirksamkeit antiretroviraler Medikamente, die nur aktive Virusvermehrung bekämpfen. Latente Reservoirs bilden somit ein Reservoir an HIV, das durch herkömmliche Behandlung nicht eliminiert werden kann. Sobald die unterdrückende ART unterbrochen wird, reaktiviert sich das Virus aus diesen Reservoirs und führt zu einem erneuten Ausbruch der Infektion. Daher gilt die effektivste Strategie im Kampf gegen HIV mit Heilungsperspektive momentan darin, die latente Infektion zu reversieren und das Virus aus seiner Versteckposition zu locken.
Herkömmliche Methoden zur Reaktivierung der HIV-Latenz stießen an Grenzen Strategien, die als „Shock and Kill“ bezeichnet werden, verfolgen das Ziel, ruhende HIV-infizierte T-Zellen zu aktivieren, damit diese das Virus produzieren und anschließend vom Immunsystem oder durch virale Zytopathie eliminiert werden. Dazu wurden sogenannte Latenz-umkehrende Agenzien (LRAs), beispielsweise Histondeacetylase-Hemmer, eingesetzt. Diese kleinen Moleküle können verschiedene Signalkaskaden in der Zelle stimulieren, was zu einer erhöhten Virus-Transkription führen soll. Dennoch zeigen klinische Studien bislang, dass diese Substanzen zwar HIV-RNA-Produktion erhöhen können, jedoch nicht in der Lage sind, die Virusreserven effizient zu verkleinern. Die Gründe dafür liegen in mehreren Ebenen der zellulären Regulation: Erstens stimulieren viele LRAs vor allem die Initiation der Transkription, überwinden jedoch nicht die Wirtszelleigenen Transkriptionsblockaden, die Elongation und Verarbeitung von viraler mRNA behindern.
Zweitens sind diese LRAs nicht spezifisch für HIV, was wiederum zu unerwünschten Nebenwirkungen und einer Einschränkung der Immunfunktionen, beispielsweise der zytotoxischen T-Zellen, führt. Somit ist klar: Um HIV-Latenz erfolgreich aufzuheben und zielsicher zu eliminieren, bedarf es präziserer und wirkungsvollerer Strategien. Die Rolle von mRNA-Technologien und Lipidnanopartikeln – ein Paradigmenwechsel Die Entwicklung von mRNA-basierter Therapie hat in den letzten Jahren durch Erfolgsgeschichten wie den COVID-19-Impfstoffen einen Quantensprung erlebt. Technologische Fortschritte in der Formulierung von mRNA in Lipid-Nanopartikeln (LNPs) erlauben einen verlässlichen Schutz der molekularen Fracht und eine effektive Zellaufnahme ohne toxische Nebenwirkungen. Diese Trägersysteme wurden zunächst erfolgreich bei genetischen Erkrankungen und Impfstoffen eingesetzt und nun auf die Therapie von schwer zugänglichen Zelltypen ausgeweitet.
Ausgerechnet die ruhenden T-Zellen, die traditionell als sehr schwer transduzierbar galten und für die konventionelle Gentransfermethoden wie Viraltransduktion oder Elektroporation unzureichend sind, können durch maßgeschneiderte LNPs effizient erreicht werden. Dabei bietet das mRNA-Prinzip große Anpassungsfähigkeit: Durch gezielte Baukastensysteme kann mRNA für verschiedene Therapeutika wie Proteine, Transkriptionsfaktoren oder sogar CRISPR-basiertes Genaktivierungsmaterial verpackt und ausgeliefert werden. LNP X – ein innovatives Lipidnanopartikel verändert das Spiel Ein neu entwickeltes Lipidnanopartikel, das als LNP X bezeichnet wird, verspricht eine deutliche Steigerung der mRNA-Transfektion effektiver in ruhende CD4+ T-Zellen ohne vorherige Stimulation. Diese Innovation basiert auf einer modifizierten Lipidzusammensetzung, bei der der als „Goldstandard“ geltende Ionisierbare Lipidbestandteil DLin-MC3-DMA durch SM-102 ersetzt wurde, begleitet von dem pflanzlichen Cholesterinanalogon ß-Sitosterol, welches synergistisch die Zellverbindung verbessert. Im Vergleich zu herkömmlichen Formulierungen führte LNP X zu mehr als 75 % Transfektionseffizienz in ruhenden T-Zellen – ein bisher unerreichtes Level bei gleichzeitig minimalen zelltoxischen Effekten.
Entscheidend ist, dass die Zellaktivierung, die für andere Methoden zur Aufnahme notwendig war, hier entfällt. Dies eröffnet neue Möglichkeiten für eine klinisch anwendbare, sichere und hochwirksame Therapie. Aktivierung der HIV-Transkription durch mRNA-codiertes HIV-Tat-Protein Im Herzen der HIV-Transkription steht das virale Tat-Protein. Tat fungiert als Transaktivator und bindet spezifisch an die TAR-Region der naszierenden HIV-RNA, was zu einer Steigerung der Transkriptions-Elongation führt. Durch gezielte mRNA-Lieferung von codon-optimiertem Tat über LNP X konnte bei ex vivo isolierten CD4+ T-Zellen von Menschen mit HIV unter ART eine signifikante Aktivierung sämtlicher Phasen der viralen Transkription beobachtet werden – von Initiierung bis zur Spaltung der viralen mRNA.
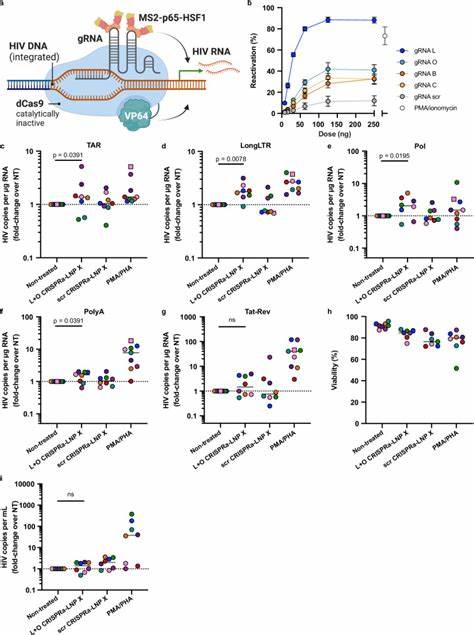
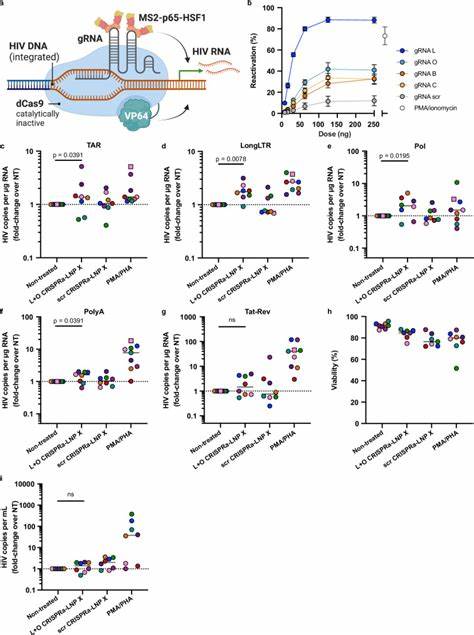
Dieses beeindruckende Resultat übertraf sogar die Wirkung traditioneller Stimulanzien wie PMA/PHA, die zwar kräftig aktivieren, aber mit unerwünschter T-Zell-Aktivierung einhergehen. Der entscheidende Vorteil der Tat-mRNA-Fracht liegt darin, dass sie latent infizierte Zellen reaktiviert, ohne die Gesamtaktivierung des Immunsystems zu induzieren. Zusätzlich konnten erhöhte Mengen an viralem RNA im Zellüberstand nachweisbar gemacht werden, was auf eine neu entstandene Virusproduktion hindeutet – ein wichtiger Schritt hin zur Eliminierung infizierter Zellen. CRISPRa-Technologie in Kombination mit LNP X zur spezifischen und effizienten HIV-Latenz-Umkehr Neben HIV-Tat ermöglicht die mRNA-LNP-Technologie auch die Anwendung von CRISPR-basierten Aktivatorsystemen, bekannt als CRISPRa. Hierbei wird eine enzymatisch inaktive Cas9-Variante (dCas9) mit Transkriptionsaktivator-Domänen wie VP64 fusioniert, die gemeinsam mit speziell entworfenen Guide-RNAs (gRNAs) gezielt die HIV-Genom-LTR aktivieren, ohne die Wirtszellgene zu beeinflussen.
Die Ko-Verabreichung der drei Komponenten des CRISPRa-Systems (dCas9-VP64 mRNA, MS2-p65-HSF1 mRNA und gRNA) in einem einzelnen LNP X zeigte erstmalig die erfolgreiche Transfektion und Aktivierung in primären, ruhenden T-Zellen. Durch gezielten Einsatz von gRNAs, die an verschiedene Bereiche des HIV-LTR binden, wurden in Zelllinien und ex vivo CD4+ T-Zellen signifikante Erhöhungen viraler Transkripte erzielt. Obwohl die Effektstärke derzeit noch hinter der von Tat-mRNA liegt, bietet CRISPRa-LNP X einen hochspezifischen, genomzielgerichteten Ansatz zur Aktivierung latenter Viren mit minimiertem Off-Target-Risiko und ohne generelle Zellaktivierung. Potenzial und Ausblick für mRNA-basierte HIV-Therapeutika Die von LNP X ermöglichte effiziente und schonende Übertragung von mRNA in ruhende T-Zellen eröffnet ein vielversprechendes Feld neuer Therapien gegen HIV. Insbesondere die Fähigkeit, HIV-spezifische Aktivatoren wie Tat oder CRISPRa zu liefern, könnte zukünftig bei der Entwicklung von kurativen Strategien entscheidend sein.
Darüber hinaus erweitert LNP X die Möglichkeiten, weitere RNA-Therapeutika oder genetische Editierungen, beispielsweise die Entfernung des HIV-Provirus durch aktive CRISPR-Cas9-Systeme oder den Knockout von CCR5, einem wichtigen HIV-Eintrittsrezeptor, direkt in T-Zellen zu realisieren. Die Technologie ist zudem nicht auf T-Zellen beschränkt und könnte für eine Vielzahl therapeutischer Zwecke bei sonst schwer transduzierbaren Zelltypen eingesetzt werden. Auch wenn bislang in vitro und ex vivo keine toxischen Effekte oder unerwünschte Immunaktivierungen beobachtet wurden, bedarf es weiterer Untersuchungen zur Sicherheit, Biodistribution und Immunogenität der LNP X-basierten Therapien. Die Optimierung der In-vivo-Zielgerichtetheit und Dosierung können zukünftig die klinische Umsetzung deutlich erleichtern. Fazit Die effiziente Lieferung von mRNA in ruhende T-Zellen mit der innovativen LNP X Plattform stellt einen bemerkenswerten Fortschritt im Kampf gegen HIV-Latenz dar.