Die HIV-Infektion stellt trotz jahrzehntelanger Forschung und bedeutsamer Fortschritte in der antiretroviralen Therapie (ART) weiterhin eine bedeutende gesundheitliche Herausforderung dar. Ein zentrales Hindernis auf dem Weg zu einer Heilung von HIV ist das sogenannte latente Virusreservoir, vor allem in ruhenden CD4+ T-Zellen. Diese Zellen tragen integrierte, aber inaktiven HIV-Provirus-DNA, die eine Virusproduktion verhindern und somit der Immunüberwachung entgehen. Die latenten HIV-Reservoire entziehen der antiretroviralen Therapie ihre Wirksamkeit und können bei Beendigung der Behandlung eine erneute Virusvermehrung bewirken. Daraus ergibt sich die dringende Notwendigkeit, effektive Strategien zu entwickeln, die diese Latenzphase aufbrechen und das Virus dadurch sichtbar für das Immunsystem machen, um letztlich eine vollständige Eliminierung des Virus zu erreichen.
In den letzten Jahren hat die bahnbrechende mRNA-Technologie, kombiniert mit der Entwicklung innovativer Lipid-Nanopartikel (LNPs), einen enormen Fortschritt im Bereich der Gentherapie und Impfstoffentwicklung ermöglicht. Klinische Erfolge wie die mRNA-basierten COVID-19-Impfstoffe haben ihr enormes Potential unterstrichen, indem sie genetische Informationen sicher und effizient in schwer erreichbar Zellen transportieren konnten. Basierend auf diesem technologischen Fundament eröffnet sich nun die Möglichkeit, therapeutische mRNA gezielt in ruhende CD4+ T-Zellen zu transportieren, um die HIV-Latenz zu reaktivieren. Ein bedeutender Entwicklungsschritt hierzu ist die Formulierung von LNP X, einem speziell optimierten Lipid-Nanopartikel, der die effiziente Aufnahme von mRNA in ruhende T-Zellen erlaubt. Im Gegensatz zu früheren LNP-Formulierungen, die nur in aktivierten oder proliferierenden T-Zellen wirksam waren, ermöglicht LNP X eine Transfektion von bis zu 75 % ruhender CD4+ T-Zellen ohne die Notwendigkeit einer vorherigen Zellaktivierung.
Damit wird erstmals ein entscheidendes technisches Hindernis überwunden, da ruhende T-Zellen als besonders schwer transduzierbar galten. Die Sicherheit der LNP X-Formulierung wurde dabei durch minimalen zellulären Stress und nahezu keine T-Zell-Aktivierung nachgewiesen. Die herausragende Effizienz von LNP X basiert auf seiner einzigartigen Lipidzusammensetzung. Der Ionisierbare Lipidbestandteil SM-102 verbessert die Freisetzung der mRNA in das Zellplasma, während das Cholesterinanalogon β-Sitosterol die Aufnahme und Verteilung der Nanopartikel optimiert. Interessanterweise ist das gesteigerte Transfektionsergebnis nicht auf eine erhöhte Endosomen-Flucht, sondern vielmehr auf eine verbesserte Translation der mRNA im Zytosol zurückzuführen.
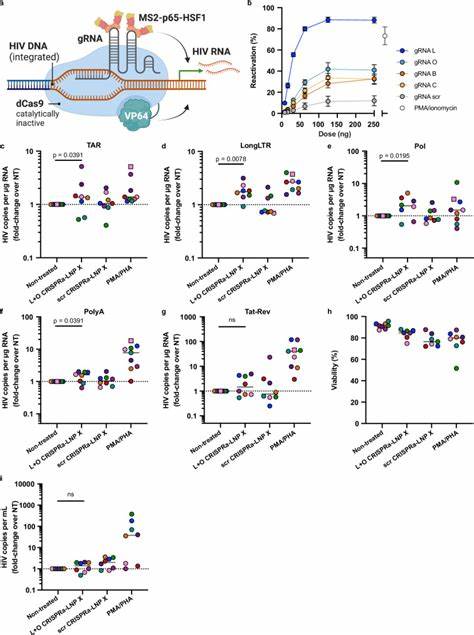
Diese Zusammenhänge konnten mithilfe spezieller Reporterassays bestätigt werden, die Zellassoziation, intrazellulären mRNA-Transport und Proteinexpression messen. Als therapeutisches Mittel wurde mRNA kodierend für das HIV-spezifische Protein Tat in LNP X verpackt (Tat-LNP X). Das Tat-Protein ist für die Transkriptionsaktivierung des HIV-Genoms essenziell und bindet an die TAR-Region der viralen RNA, um die Transkriptionsverlängerung entscheidend zu fördern. So kann es effektiv die latente Virusaktivität reaktivieren. In Zellkulturmodellen und vor allem in ruhenden CD4+ T-Zellen von HIV-infizierten Patienten unter ART konnte Tat-LNP X signifikant die Expression viertom und verschiedener HIV-RNA-Transkripte anregen.
Dabei übertraf die Wirkung von Tat-LNP X sogar die mit klassischen Mitogenen induzierte Aktivierung, jedoch ohne deren unerwünschte globale Zellaktivierung. Dies unterstreicht das Potenzial von Tat-LNP X als hochspezifischen Latency-Reverser mit geringem Nebenwirkungsprofil. Darüber hinaus zeigt die Technologieplattform LNP X die Fähigkeit, noch komplexere RNA-Moleküle zu transportieren. Beispielsweise wurde erfolgreich die CRISPRa-Technologie (CRISPR activation) in einem mRNA-LNP-System in ruhende T-Zellen eingeführt. CRISPRa nutzt eine inaktive Cas9-Nuklease (dCas9) gekoppelt mit transkriptionsaktivierenden Domänen, um gezielt endogene Genexpression zu modulieren.
In diesem Ansatz werden zusätzlich Guide RNAs (gRNAs) mitentwickelt, die spezifisch an die HIV-Latenzregion im Promotor binden. Damit gelingt eine zielgerichtete, genomische Aktivierung der latenten Viren. Obwohl die Reaktivierung nicht ganz an die Effektivität von Tat-LNP X heranreicht, stellt sie dennoch eine innovative, hochspezifische Strategie dar, die ohne globale Zellaktivierung auskommt. Der Weg von der präklinischen Forschung zur klinischen Anwendung birgt noch mehrere Herausforderungen. Die in vivo-Verteilung, Immunogenität und optimale Dosierung der LNP X-basierten Therapeutika müssen umfassend untersucht werden.
Erste Berichte belegen jedoch die Tolerabilität von LNP-basierten mRNA-Therapien beim Menschen. Zudem könnten zukünftige Erweiterungen den gezielten Transport der Nanopartikel hin zu T-Zellen durch Ligand- oder Antikörper-Guided Targeting verbessern, wodurch Nebenwirkungen weiter minimiert und therapeutische Effizienz maximiert werden können. Neben der direkten Reaktivierung der HIV-Latenz bieten mRNA-LNP-Systeme ein vielseitiges Werkzeug zur Kombination mit anderen therapeutischen Ansätzen. Beispielsweise könnte nach der effizienten Reaktivierung das Immunsystem durch therapeutische Impfstoffe oder Immuncheckpoint-Inhibitoren aktiviert werden, um die virusproduzierenden Zellen zu eliminieren. Alternativ lassen sich wirksame Sensibilisatoren für Apoptose in das System integrieren, um latente Infektionen durch direkte zelltötende Mechanismen zu reduzieren.
Insgesamt markieren Fortschritte wie LNP X und Tat-mRNA die innovative Wende in der HIV-Forschung. Sie zeigen, dass es möglich ist, gezielt schwer zugängliche T-Zell-Populationen zu erreichen, um den latenten Virus zu „wecken“ – eine Voraussetzung, um die verbliebenen HIV-Reservoire auszulöschen und die Langzeitremission oder sogar Heilung von HIV zu ermöglichen. Dabei steht die Spezifität, Effizienz und Verträglichkeit der therapeutischen mRNA-Lipid-Nanopartikel im Vordergrund. Darüber hinaus sind diese Technologien nicht nur für HIV relevant, sondern eröffnen generell Perspektiven für die Behandlung verschiedener chronischer Infektionen, Autoimmunerkrankungen oder sogar die Entwicklung neuartiger Immuntherapien bei Krebs. Die Flexibilität von mRNA als Therapeutikum, gekoppelt an eine hochspezifische Übertragungstechnik wie LNP X, verdeutlicht, welch großes Potenzial diese biomedizinische Innovation für die Zukunft der personalisierten Medizin bereithält.
Abschließend lässt sich sagen, dass die effiziente mRNA-Übertragung in ruhende CD4+ T-Zellen durch LNP X einen bedeutenden Durchbruch auf dem Weg zur HIV-Heilung darstellt. Mit der Fähigkeit, gezielte, potente und zugleich schonende Aktivierung der HIV-Latenz zu ermöglichen, setzt diese Technologie neue Maßstäbe und könnte die nächste Generation an funktionellen Heilungsstrategien maßgeblich prägen. Die weitere Entwicklung, Optimierung und klinische Prüfung solcher mRNA-basierten Therapeutika wird mit Spannung erwartet und könnte einen Wendepunkt in der Behandlung dieser hartnäckigen Viruserkrankung markieren.