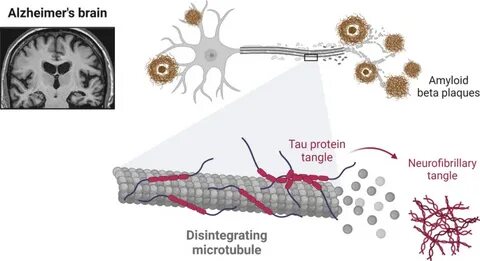
Die Alzheimer-Krankheit gilt als eine der kompliziertesten neurodegenerativen Erkrankungen unserer Zeit und stellt aufgrund ihrer weitreichenden Auswirkungen auf Patienten und ihre Familien eine enorme Herausforderung dar. Während die Ansammlung von abnormalen Proteinablagerungen wie Tau-Fibrillen und Amyloid-Beta-Plaques seit Jahrzehnten als charakteristisches Merkmal der Erkrankung bekannt ist, entwickelt sich das Verständnis ihrer genauen Rolle und Entstehung stetig weiter. In den letzten Jahren rückt insbesondere die Bedeutung von Tanycyten – spezialisierte Gliazellen im Gehirn – in den Fokus der Alzheimer-Forschung. Diese Zellen könnten nicht nur in der Reinigung des neuronalen Abfalls eine entscheidende Rolle spielen, sondern auch unmittelbar an der Bildung und Stabilisierung der pathologischen Strukturen beteiligt sein, die das Fortschreiten der Krankheit bestimmen. Tanycyten sind spezialisierte Zellen, die sich in einer einzigartigen anatomischen Position befinden, insbesondere im Bereich der dritten Gehirnventrikel.
Der Begriff leitet sich von ihrem typischen Aussehen ab: lange, fadenförmige Ausläufer, die tief in die Gehirnsubstanz hineinreichen. Traditionell sind Tanycyten vor allem für ihre Rolle im Stoffwechsel und der neuroendokrinen Regulation bekannt. Neuere Forschungsansätze weisen jedoch darauf hin, dass Tanycyten durch ein Netzwerk von Kanälen mit Aquaporin-4 (AQP4) ausgestatteten Wasserkanälen eine aktive Rolle bei der Aufnahme und Entsorgung von Abfallstoffen im Gehirn übernehmen könnten. Die Bedeutung der Abfallbeseitigung für die Gesundheit des Gehirns kann nicht hoch genug eingeschätzt werden. Die Ansammlung von toxischen Proteinen, darunter Amyloid-Beta (Aß) und Tau, führt zu einer Schädigung der neuronalen Netzwerke und letztlich zu kognitivem Abbau und Gedächtnisverlust, die für Alzheimer charakteristisch sind.
Die traditionelle Hypothese besagt, dass bei Alzheimer die natürliche Clearance dieser Abfallprodukte beeinträchtigt ist. Die neueren Forschungsergebnisse zur Rolle der Tanycyten und des AQP4-exprimierenden Gliazellnetzwerks erweitern dieses Verständnis erheblich. Es wird vermutet, dass Tanycyten ein spezielles Kanalsystem bilden, das entscheidend zur interzellulären Aufnahme von Abfallstoffen beiträgt und diese in sogenannten „Swell-Bodies“ – also auffällig vergrößerte, wassergefüllte Zellstrukturen – sammelt. Diese „Swell-Bodies” weisen eine immunreaktive Markierung für Amyloid-Beta auf, was darauf hindeutet, dass Aß nicht nur als toxisches Abfallprodukt, sondern auch als strukturelles Element innerhalb dieses Reinigungssystems fungiert. Dieses neue Modell bietet eine faszinierende Perspektive: Amyloid-Beta könnte ursprünglich eine schützende oder stützende Rolle übernehmen, indem es die Stabilität und Integrität des Kanalsystems gewährleistet, um den reibungslosen Abtransport von Abfallstoffen sicherzustellen.
Das Ungleichgewicht oder eine Überaktivierung dieses Systems kann jedoch zu einer pathologischen Akkumulation führen, die die charakteristischen Amyloid-Plaques bei Alzheimer bildet. Parallel hierzu scheint das Tau-Protein eine regulatorische Funktion bei der Freisetzung dieser Abfallstrukturen innezuhaben. Tau, ein Protein, das normalerweise für die Stabilisierung von Mikrotubuli in Neuronen verantwortlich ist, könnte im Rahmen des Tanycyten-Netzwerks maßgeblich die Quantität und Geschwindigkeit der Abfallabgabe steuern. Eine Dysregulation dieses Mechanismus kann dazu führen, dass überschüssiges oder falsch gefaltetes Tau sich in Form von neurofibrillären Tau-Fibrillen innerhalb des Gehirngewebes ansammelt. Diese Fibrillen beeinträchtigen dadurch nicht nur die neuronale Funktion, sondern beeinträchtigen ebenfalls die Reinigungsfähigkeit des Gehirns weiter.
Die Verbindung zwischen Tanycyten, Amyloid-Beta und Tau eröffnet somit einen vielversprechenden Forschungsstrang, der traditionelle Sichtweisen über Alzheimer ergänzt und neue therapeutische Ansätze ermöglichen könnte. Die Vorstellung, dass Alzheimer-typische Plaques und Fibrillen als hypertrophe, pathologisch veränderte Bestandteile eines ursprünglich schützenden Glia-Kanalsystems zu begreifen sind, erlaubt es, die Entstehung der Krankheit aus einer ganz anderen Perspektive zu betrachten. Dies könnte auch erklären, warum bisherige Therapieversuche, die lediglich auf die Beseitigung von Amyloid-Beta abzielten, oft wenig Erfolg zeigten. Es gilt somit verstärkt, die Funktion und Regulation der Tanycyten und ihres Aquaporin-4-Netzwerks zu erforschen. Eine weitere Herausforderung besteht darin, die komplexen Interaktionen zwischen neuronalen, glialen und vaskulären Komponenten zu verstehen, die das Arbeitsumfeld der Tanycyten prägen.
Hinzu kommt, dass es Unterschiede zwischen Tiermodellen und dem menschlichen Gehirn gibt, die durch moderne Techniken wie correlative Licht- und Elektronenmikroskopie besser untersucht werden können. Aktuelle Studien an menschlichem Gewebe liefern wertvolle Daten, die das Wissen aus der Tierforschung validieren und vertiefen. Neben der Grundlagenforschung eröffnet die Rolle der Tanycyten neue potenzielle diagnostische Marker. Durch spezifische Expressionen von AQP4 und anderen Genen im Zusammenhang mit diesen Zellen sowie deren pathologischen Veränderungen könnten neuartige Bildgebungsverfahren oder Biomarker entwickelt werden, die eine frühzeitige Erkennung von Alzheimer ermöglichen. Dies ist besonders wichtig, da therapeutische Erfolge meist nur in frühen Krankheitsstadien möglich sind.
Darüber hinaus weisen erste Forschungsergebnisse darauf hin, dass die gezielte Modulation der Tanycyten-Funktion – etwa durch Anpassung der AQP4-Aktivität – neuroprotektive Effekte haben könnte. Ein besseres Verständnis der molekularen Signale, die die Differenzierung und Hypertrophie dieser Gliazellen steuern, könnte daher neue Ansätze für Medikamente liefern. Solche Therapien würden nicht auf die bloße Entfernung von Proteinablagerungen setzen, sondern auf eine Wiederherstellung ihrer physiologischen Rolle in der Abfallentsorgung. Insgesamt liefert die Erkenntnis über die Rolle der Tanycyten im Zusammenhang mit Tau-Fibrillen und Amyloid-Beta-Plaques tiefgreifende Einblicke in die Pathogenese der Alzheimer-Krankheit. Sie erweitert unser Bild von der Erkrankung von einer reinen Ablagerungsstörung hin zu einer komplexen Fehlregulation eines zellulären Kanalsystems.
Dieser Paradigmenwechsel kann langfristig zu innovativen Behandlungsstrategien führen, die das Potential haben, die Lebensqualität betroffener Patienten deutlich zu verbessern. Die künftige Alzheimer-Forschung wird davon profitieren, die Rolle der Tanycyten noch intensiver zu untersuchen und diese Erkenntnisse mit anderen pathologischen Veränderungen in der Erkrankung zu verknüpfen. Durch interdisziplinäre Ansätze, die modernste bildgebende Verfahren, molekulare Biologie und klinische Studien verbinden, lässt sich hoffentlich ein besseres Verständnis und damit effektive Therapien gegen diese verheerende Krankheit entwickeln.