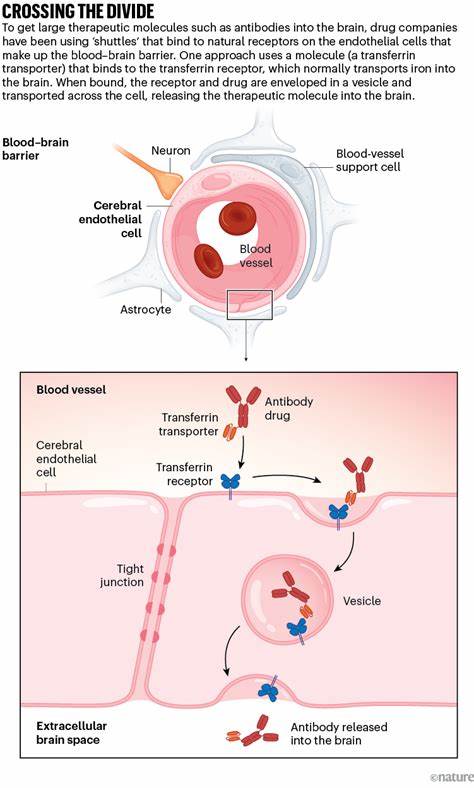
Die Blut-Hirn-Schranke – eine natürliche Schutzbarriere, die das Gehirn vor schädlichen Stoffen aus dem Blutkreislauf bewahrt – war jahrzehntelang das wohl größte Hindernis in der Wirkstoffentwicklung für neurologische Erkrankungen. Während kleine und fettlösliche Moleküle diese Schranke relativ einfach überwinden konnten, blieben große biologische Arzneistoffe – darunter Enzyme, Antikörper und virale Vektoren für Gentherapien – fast vollständig ausgesperrt. Doch die Zeiten ändern sich dramatisch. Neue molekulare Transportsysteme und sogenannte „Brain Shuttles“ machen es möglich, Medikamente gezielt durch diese Barriere zu schleusen und direkt an ihre Wirkort im Gehirn zu bringen. Der wissenschaftliche und medizinische Fortschritt in diesem Bereich verspricht einen Paradigmenwechsel in der Behandlung von diversen Hirnerkrankungen aller Art, von seltenen Erbkrankheiten bis hin zu weit verbreiteten neurodegenerativen Leiden wie Alzheimer.
Das Gehirn: ein extrem geschütztes Organ Das menschliche Gehirn ist einer der empfindlichsten und zugleich wichtigsten Organe unseres Körpers. Um eine optimale Funktion zu gewährleisten, ist es von der Blut-Hirn-Schranke umgeben – einer dichten Schicht aus eng aneinanderliegenden Zellen, die nur bestimmten Substanzen den Durchtritt erlaubt. Diese Barriere ist lebenswichtig, da sie einerseits vor giftigen und infektiösen Substanzen schützt, andererseits aber auch zahlreiche Medikamente vom Zugang zum Gehirn abhält. Bis dato konnten nur kleine, fettlösliche Moleküle oder solche, die spezifische, natürliche Transportmechanismen nutzen, die Schranke passieren. Für viele Krankheitserreger und lebensnotwendige Medikamente stellte die Blut-Hirn-Schranke daher ein unüberwindliches Hindernis dar.
Die Herausforderung großer Moleküle In den letzten Jahrzehnten gewannen biologische Therapeutika – wie Antikörper und Enzymersatzstoffe – immer mehr an Bedeutung. Diese großmolekularen Substanzen bieten völlig neue Möglichkeiten, krankheitsverursachende Prozesse zu unterbrechen oder genetische Defekte zu korrigieren. Ein Beispiel dafür ist das seltene Hunter-Syndrom, eine schwere genetische Erkrankung, bei der ein wichtiges lysosomales Enzym fehlt und die ohne Behandlung zu schweren körperlichen und geistigen Beeinträchtigungen führt. Obwohl ein Enzymersatzansatz seit vielen Jahren existiert, scheiterte die Behandlung daran, dass das große Enzym die Blut-Hirn-Schranke nicht überwinden konnte – was die kognitiven Symptome unkontrolliert ließ. Neue Chancen durch molekulare Shuttles Der bisher vielversprechendste Lösungsansatz besteht darin, therapeutische Wirkstoffe an Moleküle zu koppeln, die natürliche Transportsysteme des Gehirns ausnutzen.
Eine der erfolgreichsten Strategien basiert auf dem Eisen-Transportmechanismus des Gehirns. Eisen, ein essentielles Spurenelement für viele Hirnfunktionen, wird im Blut an das Protein Transferrin gebunden und dann in speziellen Zellen des Blut-Hirn-Übergangs über den sogenannten Transferrin-Rezeptor ins Gehirn transportiert. Wissenschaftler haben es geschafft, Teile von Antikörpern so zu konstruieren, dass sie den Transferrin-Rezeptor erkennen und binden können, ohne dessen reguläre Funktion zu stören. Therapeutische Proteine oder virale Vektoren werden an diese „Shuttle“-Moleküle gekoppelt und auf diesem Weg sicher ins Gehirn transportiert. Anwendungsbeispiele und klinische Erfolge Diese bahnbrechende Technologie wird bereits in klinischen Studien getestet.
Bei Patienten mit Hunter-Syndrom zeigen die ersten Ergebnisse, dass die kognitiven Symptome positiv beeinflusst werden. So berichtet eine Mutter von drei betroffenen Kindern, dass sich deren Hörvermögen verbessert hat und die Kinder nun motorische Meilensteine erreichen, die zuvor undenkbar erschienen. Besonders beeindruckend ist, dass das jüngste Kind die Behandlung bereits im Säuglingsalter erhalten hat und bislang keine Symptome entwickelt hat – ein Hoffnungsschimmer für viele Familien, für die die Krankheit bislang ein unvermeidbares Schicksal war. Auch bei Alzheimer sind erste Antikörper zugelassen worden, die direkt gegen die krankheitsverursachenden Proteinablagerungen (Amyloid-Plaques) wirken. Doch bisher gelang es nur einem winzigen Bruchteil der infundierten Medikamente, die Blut-Hirn-Schranke zu überwinden.
Dies führte zu sehr hohen Therapiedosen mit möglichen Nebenwirkungen und limitierten Erfolge. Die neuen Brain-Shuttle-Technologien sollen hier Abhilfe schaffen, indem sie Antikörper effizienter und gezielter ins Gehirn transportieren und so Nebenwirkungen reduzieren und die therapeutische Wirkung verbessern. Herausforderungen und Zukunftsaussichten Trotz des enormen Fortschritts steckt das Feld der Gehirntransporter noch in den Kinderschuhen. Es gibt viele offene Fragen hinsichtlich der genauen Steuerung der Therapie im Gehirn, der Verteilung der Medikamente an die betroffenen Hirnregionen sowie der langfristigen Sicherheit. Der Umgang mit unterschiedlichen Krankheitsbildern erfordert unterschiedliche Herangehensweisen, da verschiedene Erkrankungen auch unterschiedliche Hirnareale und Zelltypen betreffen.
Ein wesentlicher Punkt ist, die Balance zu finden, dass das Shuttle-System den natürlichen Transportmechanismus nicht stört und keine toxischen Nebenwirkungen hervorruft. Außerdem stehen die Forscher vor der Aufgabe, die Herstellung dieser künstlichen Moleküle so kosteneffizient wie möglich zu gestalten, um eine breite Verfügbarkeit der Therapien zu gewährleisten. Durchbruch für weitere Anwendungsgebiete Neben seltenen genetischen Erkrankungen und Alzheimer könnten die neuen Technologien auch für die Behandlung von Hirntumoren, Parkinson, Multipler Sklerose und anderen neurodegenerativen sowie neuroinflammatorischen Erkrankungen von großer Bedeutung sein. Außerdem bieten sie Potenzial für eine verbesserte Gentherapie von Hirnerkrankungen, indem virale Vektoren effizient in die relevanten Hirnzellen eingeschleust werden können. Sehr spannend ist auch die Forschung an mikrobiellen oder nanotechnologischen Ansätzen, bei denen beispielsweise speziell modifizierte Bakterien oder Nanopartikel als Transportmittel dienen und damit neue Wege für eine präzise Wirkstoffabgabe im Gehirn eröffnen.