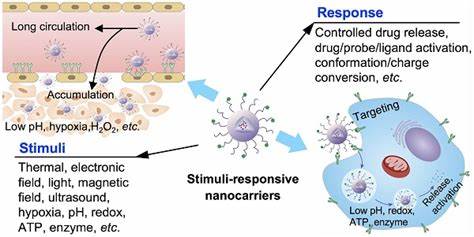
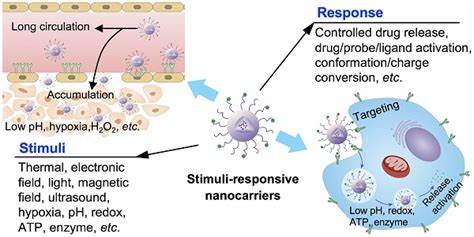
Chronische bakterielle Infektionen stellen in der heutigen Medizin eine beträchtliche Herausforderung dar, insbesondere wenn sie im Zusammenhang mit Biofilmen auftreten. Biofilme sind komplexe, mikrobiell organisierte Gemeinschaften, die sich in einer selbst erzeugten Matrix aus extrazellulärer polymere Substanz (EPS) vielfach schützen und herkömmlichen antimikrobiellen Therapien gegenüber äußerst widerstandsfähig sind. Die Barrierefunktion dieser EPS-Matrix erschwert die Arzneimittelpenetration erheblich, was in der Folge zur Entstehung therapieresistenter Infektionen führt. Vor allem Patienten mit chronischen Wunden, implantierten medizinischen Geräten oder Erkrankungen wie Zystischer Fibrose leiden unter der schwer zu kontrollierenden Biofilm-assoziierten Bakterienbesiedlung. Eine vielversprechende neue Strategie zur effektiven Medikamentenzufuhr in Biofilme liegt in der Kombination von Antimikrobiellen Wirkstoffen mit ultraschallaktivierten nanostrukturierten Trägersystemen.
Die Nanodroplet-Technologie, die auf nanoskaligen, phospholipidbeschichteten Tröpfchen basiert, revolutioniert den Ansatz der Biofilm-Therapie. Diese Nanodroplets können mit verschiedenen antimikrobiellen Wirkstoffen unterschiedlicher Klassen beladen werden, darunter Makrolide wie Azithromycin, Fluorchinolone wie Besifloxacin, antimikrobielle Peptide wie Polymyxin B und innovative Metallkomplexe wie ein modifizierter Ruthenium-Polypyridyl-Komplex. Die nanoskalige Größe dieser Tröpfchen – im Bereich von circa 125 bis 250 Nanometern – ermöglicht eine verbesserte Diffusion in dichte Biofilmmatrixen, die sonst undurchlässig für viele frei gelöste Medikamente sind. Durch therapeutischen fokussierten Ultraschall werden diese Nanodroplatten gezielt aktiviert: Die Ultraschallwellen induzieren eine sogenannte akustisch stimulierte Phasenumwandlung, bei der flüssige Nanodroplets in gasgefüllte Mikrobubble umgewandelt werden. Dieser Prozess bewirkt eine mechanische Disruption des Biofilms durch Kavitation, also Luftblasenoszillationen und Implosionen, die die EPS-Matrix partiell zerstören und so die Barriereschicht schwächen.
Gleichzeitig kommt es durch das Ultraschall-bedingte Aufplatzen der Mikroblasen zu einer kontrollierten Freisetzung des enthaltenen antimikrobiellen Wirkstoffes frontnah am Wirkungsort. Dadurch wird nicht nur die Penetration des Medikaments verbessert, sondern auch eine gezielte, lokal konzentrierte Wirkung gegen die in den Biofilm eingebetteten Bakterien erzielt. Die klinische Bedeutung dieser Technologie ist enorm. Studien mit klinisch relevanten Bakterienisolaten, wie methicillinresistentem Staphylococcus aureus (MRSA) und Escherichia coli (einschließlich ESBL-produzierender Stämme), zeigen eine dramatische Reduktion der nötigen Wirkstoffkonzentrationen durch die Kombination aus Nanodroplets und Ultraschall. Die minimalen biofilm-eradicierenden Konzentrationen (MBEC) sanken nach Ultraschallbehandlung um das bis zu 44-fache verglichen mit unbehandelten, freien Antibiotikagaben, während die vollständige Eliminierung sogenannter persister Zellen innerhalb von Biofilmen ebenfalls signifikant effizienter gelang.
Diese persister Zellen sind ruhende Bakterien, die gegen konventionelle Therapien unempfindlich sind und eine Hauptursache für Rückfälle und chronische Infektionen darstellen. Mechanistisch ist die Subzellulare Verteilung der antimikrobiellen Substanzen innerhalb der Bakterien entscheidend für die Wirksamkeit. Analysen mittels hochempfindlicher Masse-Spektrometrie zeigen, dass die Nanodroplet-Nanocarrier die Akkumulation der Wirkstoffe insbesondere in die bakterielle Membran und das Zellinnere fördern. Im Biofilm-Kontext konnte sogar eine elfmal höhere intrazelluläre Aufnahme der Wirkstoffe festgestellt werden. Die Ultraschallaktivierung verstärkt diese Effekte zusätzlich, da sie durch Kavitationseffekte die Zellmembranen permeabilisierbar macht und so einen erleichterten Wirkstoffeintritt fördert.
Diese duale Wirkweise von Ultraschall als physikalischem Biofilmzerstörer und als Auslöser für eine gezielte Medikamentenfreisetzung macht das System besonders attraktiv für die Behandlung von chronischen und refraktären Infektionen. Die Nutzung vorhandener und bewährter Antibiotika in neuartigen formulationsgebundenen Nanoträgern bietet zudem eine schnell umsetzbare, klinisch pragmatische Alternative gegenüber der Entwicklung vollständig neuer antimikrobieller Substanzen. Wichtig ist hierbei, dass die nanodroplet-basierten Systeme gut stabil und biokompatibel sind, was in Untersuchungen durch den Erhalt der Partikelgröße und -konzentration über mehr als 100 Stunden in Serum gezeigt wurde. Die Zukunftsaussichten für ultraschallgesteuerte antimikrobielle Systeme in der Infektionsmedizin sind vielversprechend. Neben der reinen Biofilmbekämpfung können die Systeme auch auf unterschiedliche Erregerarten und Infektionsumgebungen (z.
B. Urogenitaltrakt, chronische Wunden, Atemwege) angewandt werden. Durch die Kombination neuer antibiofilmwirksamer Substanzen wie enzymatischer Matrix-Abbauprodukte oder bioaktiver Gase lässt sich die Palette an anwendbaren Behandlungskonzepten erweitern. Die Ultraschallapparatur ist häufig bereits klinisch verfügbar, was die schnelle Translation und Implementierung begünstigt. Zudem adressiert die Technologie ein zentrales Problem der Antibiotikaresistenz, da sie die Wirkstoffdosen senkt, Nebenwirkungen minimiert und durch gezielte Wirkstoffabgabe und Biofilmdismantling das Entstehen von Resistenzen erschwert.
Damit eröffnet die Covalente Kombination von Ultraschallaktivierung mit hochpräzisen Nanocarriern eine neue Ära in der antimikrobiellen Therapie, die insbesondere für schwer zu behandelnde Infektionen einen Schritt voranbringt. Zusammenfassend stellt die Nutzung ultraschallgetriggerter nanodroplet-basierter Lieferplattformen eine revolutionäre Innovation dar, die die Grenzen herkömmlicher antibakterieller Behandlungsmöglichkeiten überschreitet. Durch den gezielten und effizienten Medikamententransport und die gleichzeitige mechanische Biofilmdisruption ermöglicht sie eine wirkungsvolle Bekämpfung persistenter Biofilminfektionen bei deutlich reduzierten Medikamentenkonzentrationen. Dieser Fortschritt stößt die Tür zu neuen, individuell anpassbaren Therapielösungen für chronische bakterielle Infektionen auf, mit Potenzial zur Verbesserung der Patientenversorgung und zur Eindämmung des weltweiten Problems antibiotischer Resistenzen.