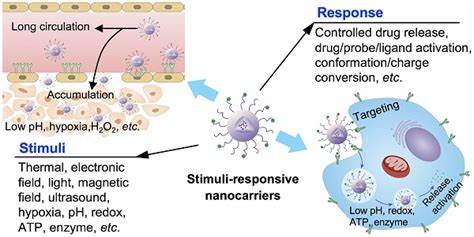
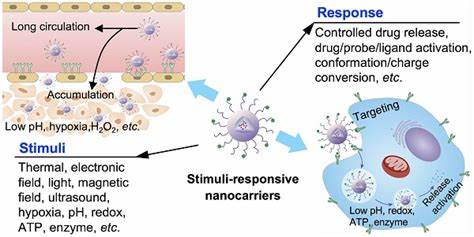
Chronische bakterielle Infektionen, die durch Biofilme verursacht werden, stellen eine der größten Herausforderungen in der modernen Medizin dar. Biofilme sind komplexe Gemeinschaften von Mikroorganismen, die sich in einer schützenden extrazellulären Matrix aus polymere Substanzen einbetten. Diese Struktur ermöglicht es den darin lebenden Bakterien, sich vor herkömmlichen Antibiotikatherapien und dem Immunsystem des Wirts effektiv zu schützen. Das Ergebnis sind hartnäckige Infektionen, die häufig eine invasive Behandlung oder den Einsatz hochdosierter Antibiotika erfordern, was wiederum zur Entstehung und Verbreitung von Resistenzen beiträgt. In den letzten Jahren hat die Forschung zunehmend innovative Ansätze zur Überwindung der Biofilm-bedingten Resistenzmechanismen untersucht.
Besonders vielversprechend sind dabei ultraschallaktivierte antimikrobielle Systeme, die eine gezielte Freisetzung von Wirkstoffen direkt in den Biofilm ermöglichen und gleichzeitig die Biofilmstruktur physikalisch stören können. Diese Technologie basiert auf nanoskaligen Trägersystemen, sogenannten Nanodroplets, die auf pharmazeutischen Kontrastmitteln beruhen und durch fokussierten Ultraschall aktiviert werden. Nanodroplets sind mikroskopisch kleine Tröpfchen, die flüchtige Perfluorcarbone enthalten und mit einer Phospholipid-Hülle stabilisiert sind. Durch Ultraschall werden diese Nanodroplets zum Verdampfen gebracht und verwandeln sich vorübergehend in Gasblasen, sogenannte Mikroblasen. Diese Mikroblasen erzeugen Scherkräfte und Kavitationseffekte, die die Biofilmarchitektur mechanisch aufbrechen und so eine verbesserte Penetration der eingekapselten antimikrobiellen Wirkstoffe ermöglichen.
Gleichzeitig erfolgt eine kontrollierte, lokalisierte Freisetzung der Medikamente direkt an der Infektionsstelle. Durch diese Synergie wird besonders die Behandlung von bakteriellen Biofilmen, etwa bei MRSA oder ESBL-positiven Infektionen, enorm verbessert. Studien zeigen, dass Nanodroplets mit vier verschiedenen antimikrobiellen Wirkstoffen beladen werden können: einem rutheniumhaltigen Komplex als metallbasiertem Antibiotikum, Azithromycin als Quorum-Sensing-Inhibitor, dem Fluorchinolon Besifloxacin und dem antimikrobiellen Peptid Polymyxin B. Jeder dieser Wirkstoffe besitzt unterschiedliche Wirkmechanismen, wodurch ein breites Wirkungsspektrum gegen Gram-positive und Gram-negative Bakterien abgedeckt wird. Die Nanodroplets bieten eine schützende Umgebung für die Wirkstoffe und verhindern vorzeitigen Abbau oder Auswaschung.
Ohne Ultraschall benötigen diese verkapselten Wirkstoffe zwar höhere Konzentrationen, doch nach Ultraschallaktivierung konnte die benötigte Antibiotikadosis um das bis zu 44-fache im Biofilm deutlich gesenkt werden, was immense klinische Vorteile bedeutet. Neben der verbesserten Wirkstofffreisetzung verändert die Ultraschallwellen-induzierte Mikroblasenkavitation auch die Subzelluläre Verteilung der Antibiotika. Untersuchungen mit hochsensibler Massenspektrometrie zeigen, dass die Nanodroplets den Wirkstoff bevorzugt in Membran und Zytoplasma der bakteriellen Zellen akkumulieren lassen. Das ist entscheidend, da viele Antibiotika in den Zytoplasma-Räumen wirken müssen, um ihre biologische Wirkung zu entfalten. Gerade bei Biofilmen, in denen die Penetration von Substanzen meist stark eingeschränkt ist, sorgt dieses Verfahren für eine bisher unerreichte Effizienzsteigerung der Therapie.
Das praktische Potenzial dieser Technologie wurde in Modellen verschiedener klinischer Infektionen bewiesen. So konnten Biofilme aus künstlicher Gelenkflüssigkeit bei Protheseninfektionen, synthetischem Harn bei Harnwegsinfekten sowie simulierten chronischen Wunden und Zystischer Fibrose realistisch nachgebildet werden. In all diesen Umgebungen führte die Kombination aus Nanodroplets mit Ultraschall zu einer drastischen Reduktion der bakteriellen Überlebensrate inklusive der sogenannten „Persister-Zellen“, die in biofilmbedingten chronischen Infektionen besonders schwer zu eliminieren sind. Überdies erlauben diese Systeme eine räumliche und zeitliche Kontrolle der Wirkstofffreisetzung, wodurch Nebenwirkungen von systemisch verabreichten Antibiotika minimiert werden können. Die Verwendung bestehender, klinisch zugelassener Substanzen und Kontrastmittel für die Nanodroplet-Herstellung bietet eine vielversprechende und schnelle Möglichkeit, den Weg in die klinische Anwendung zu ebnen.
Die Ultraschallparameter sind so gestaltet, dass sie das umliegende Gewebe schonen und nur Biofilme an der Zielstelle beeinflussen, was die Sicherheit der Therapie erhöht und die Einsatzmöglichkeiten erweitert. Aktuelle Entwicklungen in der Ultraschalltechnik, wie die Nutzung klinischer Curved-Array-Sonden in Kombination mit modernster Hochgeschwindigkeitsbildgebung, erlauben zudem eine präzise Überwachung und Feinsteuerung des Therapieprozesses. Diese technologischen Fortschritte markieren einen Paradigmenwechsel in der Behandlung bakterieller Biofilminfektionen. Sie adressieren nicht nur die biologische Komplexität der Biofilme selbst, sondern auch die pharmakologischen Herausforderungen bei der Wirkstoffübermittlung. So wird das Risiko einer erneuten Kolonisation oder Resistenzentwicklung durch die vollständige Eradikation der bakteriellen Population inklusive der Persister-Zellen signifikant gesenkt.
Darüber hinaus ist das Konzept flexibel und kann neben traditionellen Antibiotika auch andere antibiofilmwirksame Substanzen transportieren, wie zum Beispiel Matrix-abbauende Enzyme oder bioaktive Gase, die zusätzliche therapeutische Effekte entfalten können. Damit bietet es eine maßgeschneiderte Plattformtechnologie, die mit klinischer Forschung, personalisierter Medizin und neuen antibakteriellen Wirkstoffen kompatibel ist. In der Zukunft wird erwartet, dass diese ultraschallgesteuerten Nanodroplet-Systeme nicht nur in der Behandlung von Haut- und Weichteilinfektionen, sondern auch bei komplizierten Knochen- und Protheseninfektionen, chronischen Wundheilungsstörungen sowie respiratorischen Erkrankungen wie der Zystischen Fibrose breite Anwendung finden. Ihre Kombination aus mechanischer Biofilmdisruption und gezielter Antibiotikafreisetzung könnte die Therapieergebnisse deutlich verbessern, Therapiezeiten verkürzen und die Belastung durch Nebenwirkungen reduzieren. Die Integration dieser Technologie in klinische Routinen wird durch die Adaptierung vorhandener Ultraschallgeräte und bereits zugelassener pharmazeutischer Materialien erleichtert.
Dadurch entstehen nicht nur Potenziale für eine schnellere Markteinführung, sondern auch für eine kosteneffiziente Behandlung, die den Anforderungen im Zeitalter zunehmender Antibiotikaresistenzen gerecht wird. Zusammenfassend bieten ultraschallaktivierte antimikrobielle Nanodroplets einen innovativen und wirksamen Ansatz zur Überwindung der chronischen Herausforderung von Biofilm-Infektionen. Sie vereinen physikalische und pharmakologische Mechanismen in einem synergistischen Verfahren und öffnen damit neue Horizonte im Kampf gegen resistente und hartnäckige bakterielle Infektionen. Die Zukunft der antibiofilmtherapie könnte mächtiger, zielgerichteter und patientenfreundlicher werden – dank der intelligenten Verbindung von Ultraschalltechnologie und nanomedizinischer Wirkstoffabgabe.