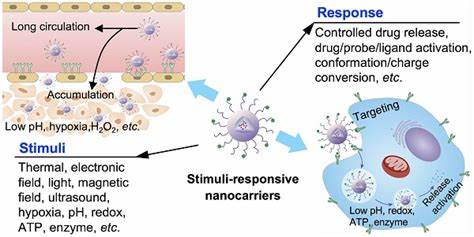
Bakterielle Infektionen stellen nach wie vor eine große Herausforderung für die moderne Medizin dar, insbesondere wenn sie durch Biofilme hervorgerufen werden. Biofilme sind komplexe, selbstproduzierte Schleimschichten, in denen sich Bakterien schützen und eine erhöhte Resistenz gegenüber herkömmlichen Antibiotika entwickeln. Die Behandlung chronischer und persistenter Infektionen, die durch solche Biofilme verursacht werden, ist aufgrund der eingeschränkten Wirksamkeit vieler Antibiotika schwierig und verlangt oft invasive Maßnahmen oder langwierige Therapien mit hohen Dosen von Medikamenten. Neue Therapieansätze, die eine gezielte und effektive Penetration dieser Biofilme ermöglichen, sind daher dringend erforderlich. Hier setzen innovative ultraschallgesteuerte nanotechnologische Systeme zur gezielten Medikamentenfreisetzung an, die eine vielversprechende Strategie darstellen, um diese Herausforderungen zu überwinden.
Biofilme und ihre Bedeutung für chronische Infektionen Biofilme sind mikrobielle Gemeinschaften, eingebettet in eine schützende extrazelluläre Matrix aus Polysacchariden, Proteinen und Nukleinsäuren. Diese Matrix bewirkt nicht nur den physischen Schutz der Bakterien, sondern erschwert auch das Eindringen von Antibiotika in die Biofilmstruktur. Zudem existieren innerhalb des Biofilms sogenannte „Dormant“ oder „Persister“ Zellen, die sich in einem niedrig metabolischen Zustand befinden und somit gegenüber antimikrobiellen Wirkstoffen besonders widerstandsfähig sind. Diese Eigenschaften führen dazu, dass Biofilme häufig Hauptverursacher von chronischen Infektionen sind, etwa bei Wundheilungsstörungen, Harnwegsinfekten oder in der Atemwegsmedizin bei zystischer Fibrose. Der konventionelle Einsatz von Antibiotika stößt an Grenzen, da diese häufig nicht in ausreichender Konzentration in den Biofilm vordringen, um die Bakterien wirkungsvoll abzutöten.
Darüber hinaus begünstigt die langsame Eliminierung von Bakterien innerhalb von Biofilmen die Entwicklung von Antibiotikaresistenzen, was den therapeutischen Erfolg zusätzlich einschränkt. Aufgrund dieser Hintergründe ist die Entwicklung neuer Methoden zur gezielten Biofilmbekämpfung ein zentrales Thema der Forschung. Ultraschallgesteuerte Nanodroplets als innovative Trägersysteme Ein neuartiger Ansatz zur Bewältigung dieser Problematik ist die Nutzung ultraschallaktivierter nanoskaliger Trägersysteme, sogenannte Nanodroplets, die mit antimikrobiellen Wirkstoffen beladen sind. Diese Nanodroplets besitzen Durchmesser im Bereich von 100 bis 250 Nanometern und bestehen meist aus phospholipidbeschichteten Perfluorcarbone-Flüssigkeitströpfchen. Unter Einfluss von therapeutischem Ultraschall können diese flüssigen Nanodroplets durch ein Phasenwechselverfahren (Acoustic Droplet Vaporization) in gasgefüllte Mikroblasen umgewandelt werden, welche durch das akustische Kavitationsphänomen mechanisch mit dem Biofilm interagieren.
Die mechanischen Effekte der Mikroblasen führen zu einer Zerstörung und Durchbrechung der Biofilmstruktur, wodurch zuvor undurchdringliche Barrieren aufgebrochen werden. Gleichzeitig wird durch die Ultraschallaktivierung die Freisetzung der antimikrobiellen Wirkstoffe gezielt und lokal verstärkt, was eine hohe Konzentration der Medikamente direkt an der Infektionsstelle sicherstellt. Die Kombination aus physischer Biofilmdisruption und gezieltem Wirkstofftransport erlaubt somit eine wesentlich effektivere Bekämpfung bakterienassoziierter Biofilme. Verschiedene Wirkstoffklassen und Synergien In der klinischen und experimentellen Anwendung wurden unterschiedliche antimikrobielle Substanzen erfolgreich in Nanodroplets integriert. Dazu zählen beispielsweise das Makrolid-Antibiotikum Azithromycin, das Fluorchinolon Besifloxacin, das antimikrobielle Peptid Polymyxin B sowie metallbasierte Wirkstoffe wie Rutheniumpolypyridyl-Komplexe.
Jede dieser Substanzen greift auf verschiedene Weise bakterielle Funktionen an, etwa die Hemmung der Quorum-Sensing Kommunikation, DNA-Replikation oder Membranstabilität. Die Kombination dieser Wirkstoffe mit einer Ultraschall-induzierten Freisetzung führt zu einer deutlichen Steigerung ihrer Wirksamkeit gegen empfindliche sowie resistente bakterielle Stämme, darunter Methicillin-resistenter Staphylococcus aureus (MRSA) und Extended-Spectrum-Beta-Lactamase (ESBL)-produzierende Escherichia coli. In Versuchen zeigten sich signifikante Reduzierungen der minimal notwendigen Wirkstoffkonzentrationen zur Erreichung der Bakterientötung sowohl in planktonischen Kulturen als auch in Biofilmen. Neben der verbesserten Penetration in die Biofilmmatrix bewirken Ultraschall-reaktive Nanodroplets eine vermehrte Aufnahme des Wirkstoffs in bakterielle Zellen. Studien mithilfe von präzisen Subzelluläranalysen (z.
B. mittels Massenspektrometrie) weisen darauf hin, dass die Nanodroplets Wirkstoffe bevorzugt in die zellulären Membran- und Cytoplasmafraktionen überführen, was bei freiem Antibiotikum häufig begrenzt ist. Die Ultraschallaktivierung verstärkt darüber hinaus vermutlich die Porenbildung in bakteriellen Membranen und fördert so die Wirkung der Medikamente. Effekte auf persistente und resistente Zellpopulationen Ein besonders kritisches Problem bei der Behandlung von Biofilmen sind so genannte Persisterzellen. Diese können trotz antimikrobieller Behandlung überleben und sind für Rückfälle nach vermeintlicher Ausheilung verantwortlich.
Ultraschallgesteuerte Nanodroplets haben das Potenzial, auch diese resilienten Zellpopulationen effektiver zu eliminieren. Untersuchungen zeigen, dass bei Anwendung der kombinierten Methode deutlich geringere Wirkstoffdosierungen ausreichen, um Persister vollständig abzutöten. Die Ultraschallbehandlung kann zudem die Reaktivierung ruhender Bakterien anregen, wodurch diese aus ihrem „Schlafzustand“ erwachen und empfindlicher gegenüber antimikrobieller Therapie werden. Das führt zu einer erhöhten Gesamtwirkung der antibiotischen Substanzen in der Biofilmumgebung. Klinische Relevanz und Anwendungspotenziale Der große Vorteil der Ultraschall-gesteuerten Nanodropletsystems liegt in der Möglichkeit einer gezielten, lokalisierbaren Medikamentenfreisetzung.
Die Verwendung klinisch zugelassener Bezugssubstanzen und kommerziell verfügbarer Ultraschallgeräte erleichtert die Translation in die Praxis erheblich. Verschiedene Infektionstypen, etwa chronische Wundinfektionen, Harnwegsinfektionen, Protheseninfektionen oder pulmonale Infektionen bei zystischer Fibrose, können potenziell mit dieser Technologie behandelt werden. Darüber hinaus ermöglicht die Plattform eine flexible Adaptierung für neuartige antimikrobielle Substanzen, biologische Enzyme oder gasförmige Wirkstoffe. Somit können auch Kombinationstherapien entwickelt werden, die die Biofilm-Matrix weiter destabilisieren oder die bakterielle Kommunikation beeinflussen und damit das Risiko einer Resistenzentwicklung verringern. Herausforderungen und zukünftige Perspektiven Obwohl die in vitro Ergebnisse sehr vielversprechend sind, sind weitere Studien zur Sicherheit, Wirksamkeit und Dosierung in vivo notwendig.
Insbesondere die Langzeitwirkungen der Nanopartikel und ihre mögliche Immunogenität gilt es zu untersuchen. Auch müssen die optimalen Behandlungsprotokolle hinsichtlich Ultraschallfrequenz, -intensität und Dauer definiert werden, um maximale therapeutische Erfolge bei minimalen Nebenwirkungen zu erzielen. Die Entwicklung biosensorisch gesteuerter Ultraschallsysteme könnte in Zukunft eine noch präzisere Steuerung der Wirkstofffreisetzung ermöglichen. Weiterhin ist das Engineering der Nanodroplets für eine verbesserte Stabilität, gezielte bakterielle Erkennung und optimierte pharmakokinetische Eigenschaften ein wichtiger Forschungsbereich. Fazit Ultraschallgesteuerte nanotechnologische Systeme zur gezielten Freisetzung antimikrobieller Wirkstoffe bieten eine innovative und effektive Lösung zur Behandlung von Biofilm-bedingten Infektionen.
Sie überwinden die Barrieren der Biofilmstruktur mechanisch und biochemisch, erhöhen die Wirksamkeit bestehender Antibiotika erheblich und reduzieren die notwendige Dosierung. Diese Technologie könnte einen entscheidenden Beitrag im Kampf gegen chronische bakterielle Infektionen und antimikrobielle Resistenzen leisten und das therapeutische Spektrum in der klinischen Infektionsmedizin erweitern. Die klinische Umsetzung verspricht eine verbesserte Patientenversorgung insbesondere bei schwer behandelbaren, persistierenden Infektionen.