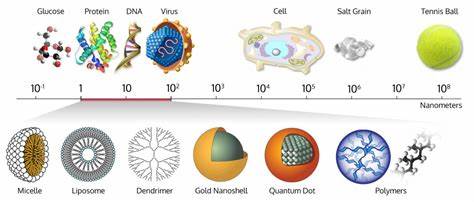
Die Analyse von Biomolekülen wie Proteinen, DNA oder kleinen organischen Verbindungen gehört zu den grundlegenden Aufgaben der modernen Biowissenschaften und der medizinischen Forschung. Die Größe und Form eines Moleküls sind entscheidende Faktoren, die nicht nur seine Funktion bestimmen, sondern auch Unterschiede zwischen molekularen Zuständen und Interaktionen aufzeigen können. Traditionelle Methoden zur Bestimmung dieser Eigenschaften sind jedoch oft zeitaufwendig, benötigen große Probenmengen und bieten keine ausreichende Auflösung, um Einzelmolekülverhalten präzise zu erfassen. Genau hier setzt eine neuartige Technologie an, die es erlaubt, molekulare Größen und Konformationen direkt und hochpräzise auf einem Mikrochip zu messen. Diese Entwicklung markiert einen entscheidenden Fortschritt im Bereich der molekularen Analytik und eröffnet neue Perspektiven für Forschung und Diagnostik.
Das Kernkonzept dieser innovativen Methode basiert auf sogenannten entropischen Fallen, die innerhalb eines mikrofluidischen Chips integriert sind. Moleküle werden zunächst mit fluoreszierenden Markern versehen, um ihre Bewegung optisch verfolgen zu können. Auf dem Chip befinden sich winzige Spalte oder Kammern mit eng abgestimmten Dimensionen und periodischen Vertiefungen, die wie Fallen wirken. Moleküle diffundieren zufällig, und wenn sie in eine dieser Fallen geraten, werden sie durch physikalische Effekte, insbesondere durch Entropie, für eine bestimmte Zeit eingeschlossen. Dabei ist die Verweildauer der Moleküle in den Fallen stark von ihrer Größe und Form abhängig – größere oder anders geformte Moleküle verbringen nachweislich länger in diesen Bereichen als kleine, kompakte Moleküle.
Die Messung dieser sogenannten Escape-Time, also der Zeit, die ein Molekül benötigt, um die Falle zu verlassen, liefert äußerst genaue Informationen über dessen Hydrodynamik und räumliche Ausdehnung. Von besonderem Vorteil ist, dass die gesamte Messung unter nativen Lösungsmittelf Bedingungen erfolgt. Biomoleküle behalten dadurch ihre natürliche 3D-Konformation, ohne durch Fixierung oder Trocknung verändert zu werden. Die Methode erfasst zudem einzelne Moleküle; so wird höchstauflösende Datenanalyse möglich, die auch molekulare Heterogenität und seltene Zustände identifiziert. Dies ist ein bedeutender Fortschritt gegenüber Ensemble-Methoden, bei denen das Durchschnittssignal über viele Moleküle gemessen wird und einzelne Variationen verloren gehen.
Die Palette der Anwendungen ist beeindruckend breit. Besonders in der Untersuchung von DNA- und RNA-Nanostrukturen, kleinen Molekülen und Protein-Komplexen zeigt die Chip-basierte Methode einzigartige Stärken. So lassen sich kleinste Änderungen – sogar das Fehlen oder die Zugabe von nur zwei Kohlenstoffatomen – bei kleinen Molekülen nachweisen. In der Kinetik-Analyse können biologische Reaktionen in Echtzeit verfolgt und Wechselwirkungen zwischen Molekülen über einen gigantischen Bereich von Bindungsaffinitäten quantifiziert werden. Damit eignet sich die Technologie hervorragend, um den Verlauf enzymatischer Reaktionen, Bindungsprozesse oder Konformationsänderungen mit bisher unerreichter Genauigkeit zu untersuchen.
Die diagnostischen Potenziale sind ebenso beeindruckend. Als anschauliches Beispiel dient die Erkennung von Insulin-Konzentrationen im Serum durch Erfassung von ligand-vermittelten Konformationsänderungen am Insulinrezeptor. Diese hochempfindliche, schnelle Messmethode könnte in Zukunft personalisierte Diagnostik auf minimaler Probenmenge ermöglichen und dabei helfen, Erkrankungen wie Diabetes noch früher und mit größerer Präzision zu diagnostizieren. Weiterhin ist die Chip-Technologie äußerst skalierbar und erlaubt Hochdurchsatzmessungen. Dies bedeutet, dass Millionen von Molekülen parallel analysiert und deren Daten in Echtzeit ausgewertet werden können.
Dies ist besonders wertvoll für die Modellierung dreidimensionaler Strukturen mittels Künstlicher Intelligenz und Maschinellem Lernen. Die gewonnenen Daten können die Vorhersage biologischer Strukturen verbessern, indem sie experimentelle Referenzpunkte zu molekularer Größe und Konformation liefern. Im Gegensatz zu klassischen Techniken wie der kleinen Winkelstreuung (SAXS), der Kernspinresonanz (NMR) oder Einzelmolekül-Förster-Resonanz-Energietransfer (smFRET) überzeugt die neue Methode durch ihre Kombination von hohen Durchsatzraten, Empfindlichkeit und den Verzicht auf aufwändige Probenvorbereitung. Zudem ist die Technologie flexibel in der Anpassung der Messtopologie und der Größenordnung der erfassten Moleküle, wodurch sie in verschiedensten Forschungsfeldern einsetzbar ist. Entscheidend für den Erfolg der Technik war die interdisziplinäre Zusammenarbeit zwischen Physik, Chemie, Biologie und Ingenieurwissenschaften.
Fortschritte in der Mikrofabrikation ermöglichten die Herstellung präziser nanoskaliger Strukturen, während die Kombination mit hochauflösender Fluoreszenzmikroskopie das Nachverfolgen einzelner Moleküle in flüssiger Phase erlaubte. Die Softwareentwicklung zur zuverlässigen Analyse der komplexen Bewegungsmuster trug ebenso zur Leistungsfähigkeit bei. Zukunftsweisend sind auch potentiale Erweiterungen wie die Integration zusätzlicher Sensorik für Temperatur, pH oder elektrische Felder auf dem Chip. Dies würde erlauben, Umwelteinflüsse auf molekulare Konformationen zu unterscheiden und detaillierter zu untersuchen. Zudem eröffnet der Einsatz multiplexfähiger Fluoreszenzmarker das gleichzeitige Messen verschiedener Molekültypen oder Zustände in einem Experiment.
Insgesamt stellt die Messung von molekularer Größe und Form auf einem Chip eine Revolution in der Biophysical Chemie und Molekularbiologie dar. Sie bietet eine noch nie dagewesene Kombination von Präzision, Sensitivität und Geschwindigkeit. Dies wird tiefgreifende Auswirkungen auf Forschung, Diagnostik und Wirkstoffentwicklung haben und neue Einblicke in die Dynamik und Struktur biologischer Systeme liefern. Mit der fortschreitenden Entwicklung und kommerziellen Verfügbarkeit dieser Technologie steht zu erwarten, dass sie in den kommenden Jahren zu einem Standardwerkzeug in Laboren weltweit wird. So werden komplexe molekulare Prozesse, die bis dato schwer zugänglich waren, direkt beobachtbar und quantifizierbar.
Dadurch kann ein fundamentaler Beitrag zur besseren Verständigung der molekularen Mechanismen von Gesundheit und Krankheit geleistet werden – ein Meilenstein für die moderne Wissenschaft und Medizin.