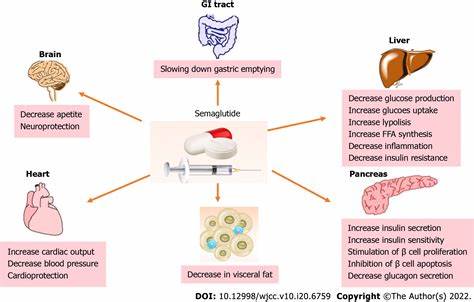
Semaglutid hat sich in den vergangenen Jahren als revolutionäres Medikament zur Behandlung von Adipositas und Typ-2-Diabetes etabliert. Dennoch sind die genauen Mechanismen, mit denen das Mittel im Gehirn wirkt, lange nur unvollständig verstanden gewesen. Neueste wissenschaftliche Studien aus der Arbeitsgruppe der Universität Göteborg werfen nun ein Licht auf eine spezifische Gruppe von Neuronen im Hirnstamm, die maßgeblich für die appetiitzügelnde und gewichtreduzierende Wirkung von Semaglutid verantwortlich sind. Diese Entdeckung könnte die Entwicklung gezielterer und nebenwirkungsärmerer Therapien gegen Übergewicht ermöglichen. Semaglutid gehört zur Klasse der GLP-1-Rezeptoragonisten, welche bei Patienten mit Übergewicht oder Diabetes eingesetzt werden, um die Nahrungsaufnahme zu reduzieren und den Energiehaushalt zu verbessern.
Gleichzeitig führt die Behandlung häufig zu unangenehmen Nebenwirkungen wie Übelkeit oder Muskelschwäche, was die Langzeitanwendung erschwert. Die neue Forschung fokussiert sich daher auf die Frage, ob die positiven Effekte von Semaglutid mechanistisch von den Nebenwirkungen getrennt werden können. Die jüngsten Experimente mit Mäusen zeigen, dass sich Neuronen in der sogenannten dorsalen Vagalkomplex-Region des Hirnstamms als entscheidend für den Einfluss von Semaglutid auf Hunger- und Fettstoffwechsel herausgestellt haben. Diese Neuronen, gekennzeichnet durch die Expression des Genprodukts Adcyap1, lassen sich durch das Medikament aktivieren und lösen somit den Appetitverlust und die Fettverbrennung aus, ohne die üblichen unerwünschten Symptome wie Übelkeit zu fördern. In Versuchen, bei denen genau diese „Adcyap1+“-Neuronen gezielt deaktiviert wurden, konnte eine signifikante Abschwächung der gewichtsreduzierenden Wirkung von Semaglutid beobachtet werden.
Interessanterweise blieben die Nebenwirkungen in diesen Versuchsgruppen jedoch erhalten, was darauf hindeutet, dass der medikamentöse Nutzen und die unerwünschten Reaktionen durch unterschiedliche neuronale Netzwerke vermittelt werden. Die Fähigkeit, diese Neuronen gezielt anzusteuern, eröffnet somit große Hoffnung für die Weiterentwicklung von Therapien, die die positiven Effekte des Medikaments nutzen, dabei aber weniger belastend für die Patienten sind. Neben dem Potenzial für eine verbesserte Behandlung von Adipositas liefert die Studie auch wertvolle Einblicke in die grundlegenden Mechanismen der Hirnsteuerung unseres Energiehaushalts. Der Hirnstamm, insbesondere die dorsale Vagalkomplex-Region, stellt eine wichtige Schnittstelle dar, über die das Gehirn Signale zur Nahrungsaufnahme und Energiebalance verarbeitet. Das Verständnis, wie Semaglutid diese Region beeinflusst, erweitert das Wissen über neuronale Steuerung von Hunger und Sättigung erheblich.
Für die Finanzierung der Untersuchung und das Vorantreiben entsprechender Forschungsprojekte ist die Kooperation zwischen Neurowissenschaftlern und klinischen Experten von großer Bedeutung. Die Rolle von GLP-1-Rezeptoren bei der Regulation von Körpergewicht und Stoffwechsel wurde durch diese Studie neu definiert und könnte weitreichende Auswirkungen auf weitere medizinische Felder haben. So werden GLP-1R-Agonisten bereits auch auf ihre Wirksamkeit bei Substanzmissbrauchserkrankungen und neurodegenerativen Erkrankungen hin untersucht. Das bessere Verständnis der Wirkmechanismen kann somit auch neue Anwendungsmöglichkeiten eröffnen und die Medikamentenentwicklung insgesamt effizienter und zielgerichteter gestalten. Besonders hervorzuheben ist die Methodik der Studie, bei der Forscher gezielt die durch Semaglutid aktivierten Neuronen identifizierten und diese ohne das Medikament durch optogenetische Stimulation direkt anregten.
Dabei zeigten die behandelten Mäuse ähnliche Verhaltensänderungen wie die mit Semaglutid behandelten Tiere – eine überzeugende Evidenz für die zentrale Rolle dieser Hirnstammneuronen. Diese innovativen Ansätze unterstreichen die Bedeutung moderner neurowissenschaftlicher Techniken für das Verständnis komplexer Medikamentenwirkungen. Für Patienten und die klinische Praxis könnten die Erkenntnisse langfristig zu Therapien führen, die effektiver sind und gleichzeitig die Lebensqualität durch weniger Nebenwirkungen verbessern. Gerade bei chronischen Erkrankungen wie Adipositas, die oft mit multiplen Begleiterkrankungen einhergehen, ist eine solche Optimierung dringend notwendig. Zusammenfassend zeigt die Forschung, dass Semaglutid seine gewichtsreduzierenden Effekte durch spezifische Adcyap1-positive Neuronen im Hirnstamm vermittelt, die sich von jenen unterscheiden, welche Nebenwirkungen verursachen.