Die Verbindung von Biologie und Machine Learning, insbesondere im Bereich der Proteinforschung, entwickelt sich zu einem der spannendsten und schnelllebigsten Felder der heutigen Wissenschaft. ProteinML, also Machine Learning, das sich auf Proteine spezialisiert, eröffnet völlig neue Möglichkeiten, biologische Prozesse zu verstehen und zu beeinflussen. Diese Technologie ist nicht nur ein wissenschaftliches Werkzeug, sondern auch ein entscheidender Faktor für die Zukunft der Arzneimittelentwicklung, Biotechnologie und sogar der synthetischen Biologie. Die rasante Entwicklung von Deep-Learning-Methoden, die direkt auf Proteine angewendet werden, verändert die Art und Weise, wie Forscher Proteine analysieren, gestalten und verbessern. Dabei ist das Wissen über die grundlegenden biologischen Prinzipien und die verfügbaren Datenquellen essenziell, um in diesem Bereich erfolgreich zu sein.
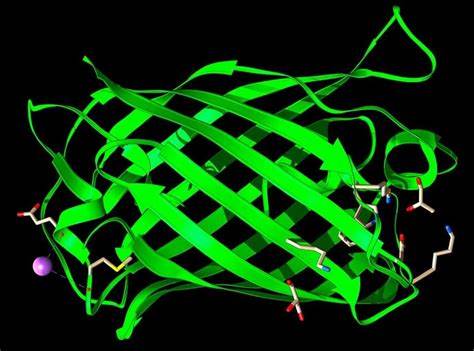
Proteine sind komplexe Makromoleküle, die aus einer Sequenz von Aminosäuren bestehen und dabei eine dreidimensionale Struktur ausbilden, die eng mit ihrer Funktion verbunden ist. Das Verständnis der 20 standardmäßigen Aminosäuren, ihrer Eigenschaften und wie sie sich zusammensetzen, stellt das Fundament für jedes ProteinML-Projekt dar. Die Reihenfolge der Aminosäuren, die sogenannte Primärstruktur, legt die Grundlage für die Sekundärstruktur mit Elementen wie Alpha-Helices und Beta-Faltblättern, die sich wiederum zu komplexeren, tertiären und quartären Strukturen zusammenfinden. Diese Strukturen bestimmen letztlich die Funktion des Proteins, sei es als Enzym, Antikörper oder Signalträger. Um heutzutage aussagekräftige Modelle zu entwickeln, bedarf es guter Daten – ein zentraler Grundsatz für jeden Machine-Learning-Forscher, der auch in der Bioinformatik gilt.
Proteindaten liegen meist in Form von Sequenzen und Strukturen vor. Sequenzdaten sind relativ leicht zu erfassen und in großen Datenbanken verfügbar, während Strukturinformationen häufig schwerer zu erhalten sind, da sie mit aufwendigeren Methoden wie Röntgenkristallographie oder Kryo-Elektronenmikroskopie gewonnen werden. Die Erfassung der Eigenschaften von Proteinen, etwa ihrer Aktivität, Stabilität, Löslichkeit oder Affinität zu verschiedenen Molekülen, ergänzen diese Datenbasis und sind entscheidend für prädiktive Modelle, die beispielsweise die Wirkstoffbindung verbessern sollen. Im Bereich der Bioinformatik haben sich große, öffentlich zugängliche Datensätze etabliert, die als Grundlage für Machine-Learning-Modelle dienen. Dazu gehören umfangreiche Sequenzdatenbanken wie UniProt oder UniRef sowie strukturbezogene Daten aus der Protein-Datenbank PDB oder dem Alphafold Protein Structure Database.
Neuartige, synthetisch generierte Daten, wie etwa aus dem ESM Metagenomic Atlas, erweitern die Trainingsgrundlage für Modelle und ermöglichen neue Einsichten insbesondere durch tiefe neuronale Netze. Die Einführung von AlphaFold2, eine bahnbrechende Deep-Learning-Anwendung zur Vorhersage von Proteinstrukturen, markierte einen Meilenstein und leitete die Revolution im ProteinML ein. Diese und weitere Modelle setzen oft auf Transformer-Architekturen, die ursprünglich aus der natürlichen Sprachverarbeitung stammen und es erlauben, Kontext und Beziehungen innerhalb der Aminosäuresequenz besonders effektiv zu erfassen. Modellhierarchien ermöglichen es, von der Strukturvorhersage über einzelne Protein-Eigenschaftsvorhersagen bis hin zu komplexen Generationsverfahren mit spezifischer Eigenschaftssteuerung zu arbeiten. Es gibt auch Technologien, die den umgekehrten Weg gehen, sogenannte Inverse-Folding-Modelle wie ProteinMPNN, welche aus einer Proteinstruktur die zugehörige Sequenz ableiten können.
Die Kombination verschiedener Modelle und Workflows, etwa RFDiffusion gefolgt von ProteinMPNN und anschließend AlphaFold2, spielt eine wichtige Rolle bei der neuartigen Protein- und Wirkstoffentwicklung. Neben den Proteinmodellen existieren auch spezialisierte Modelle für genetische Daten oder RNA-Sequenzen. Diese sind meist durch die Größe und Komplexität der Daten gekennzeichnet und nutzen häufig konvolutionale Netzwerke. Im praktischen Einsatz spielt die Nutzung von Multiple Sequence Alignments eine entscheidende Rolle, denn die evolutionäre Information ist ein wertvoller Hinweis, um bedeutende Proteinpositionen zu verstehen und funktional wichtige Regionen zu identifizieren. Obwohl MSAs eine Rechenhürde darstellen, bieten Tools wie MAFFT oder MMseqs2, teilweise sogar mit GPU-Beschleunigung, effiziente Lösungen.
Um die biologischen Modelle auch in realitätsnahen Szenarien zu validieren oder zu verbessern, werden Simulationen wie molekulare Dynamik eingesetzt. Diese nähern sich physikalischen Gesetzmäßigkeiten an und erlauben etwa Vorhersagen über die Stabilität eines Proteins oder seine Interaktionen. Während klassische Methoden wie Rosetta oder OpenMM dominieren, gewinnen neuronale Netzwerk-basierte Kraftfelder zunehmend an Bedeutung und werden bereits mit simulierten Differentialgleichungen verglichen. Am Ende steht häufig die Anwendung des Designs in einem biologischen System beziehungsweise Produktionsprozess. Dabei wird die DNA, die das gewünschte Protein codiert, in Wirtszellen wie E.
coli, Säugerzelllinien oder Hefen eingeführt, die das Protein dann in größeren Mengen produzieren. Verschiedene Zelltypen sind dabei für unterschiedliche Proteinkategorien besser geeignet, und der gesamte Prozess der Optimierung von Genexpressionssystemen ist ein eigenständiges, komplexes Forschungsfeld. Moderne Assay-Technologien erlauben hochpräzise Messungen von Proteinfunktionen oder Bindungsaffinitäten, deren Qualität für Machine-Learning-Algorithmen entscheidend ist. Die Vernetzung von Labortechnik und computergestützten Modellen ermöglicht zudem eine Automatisierung, die den gesamten Designzyklus beschleunigt. In Deutschland und weltweit haben sich Unternehmen wie Cradle oder Evolutionary Scale als Pioniere etabliert, die ML-gestützte Proteinentwicklung in kommerziellen Maßstab bringen.
Ebenso entstehen spezialisierte Startups, die sich auf bestimmte Aspekte wie Membranproteine, Toxizität oder spezielle Proteinfamilien konzentrieren. Akademische Gruppen, etwa von Charlotte Deane in Oxford oder David Bakers Labor in Washington, leisten weiterhin fundamentale Beiträge und treiben die Wissensbasis voran. Die ProteinML-Community ist dynamisch, rast durch Neuerungen und bietet eine Mischung aus biologischem Grundlagenwissen, technischem Machine-Learning-Verständnis und praktischer Erfahrung im Labor und bei Softwareentwicklung. Das Interesse reicht von Grundlagenforschung zu angewandter Wirkstoffentwicklung bis zur synthetischen Biologie. Für Einsteiger ist es wichtig, die zentralen biologischen Konzepte zu verinnerlichen und erste Projekte mit existierenden Modellarchitekturen und Datensätzen zu starten.
Von der Sequenz zur Struktur, von der Struktur zur Funktion, und schließlich von der Funktion zur Anwendung – diese Kette bildet das Rückgrat moderner biomedizinischer Innovation. ProteinML ist damit nicht nur ein spannendes Forschungsfeld, sondern auch ein Zukunftsmarkt, in dem technisches Know-how, biologische Expertise und Data-Science-Fähigkeiten zusammenfließen. Wer sich den Herausforderungen dieses Feldes stellt, hat die Möglichkeit, an der Spitze einer Revolution in der Gesundheit, Biotechnologie und Pharmazie mitzuwirken. Trotz der Komplexität liegen die größten Durchbrüche oft in kreativen Anwendungen der vorhandenen Technologien und im sorgfältigen Zusammenspiel zwischen Daten, Algorithmen und biologischer Einsicht. Enthusiasten und Profis gleichermaßen sollten sich daher kontinuierlich weiterbilden, neue Modelle ausprobieren und den Austausch in der Community suchen.
ProteinML verändert die Welt der Biowissenschaften – und sie verändert sie schnell.