Der Wundheilungs-Assay, auch unter dem Namen Scratch Assay bekannt, stellt eine grundlegende Methode in der Zellbiologie dar, mit deren Hilfe die Migration von Zellen in einem kultivierten Zellverband untersucht wird. Dabei wird ein definierter, zellfreier Bereich – die sogenannte ‚Wunde‘ oder ‚Scratch‘ – in einer konfluenten Zellschicht erzeugt, und es wird beobachtet, wie Zellen diesen Bereich über die Zeit hinweg besiedeln. Das Verfahren liefert wertvolle Einblicke in die Mechanismen der Zellbewegung und wird insbesondere verwendet, um den Einfluss unterschiedlicher Substanzen, Wachstumsfaktoren oder experimenteller Bedingungen auf die Zellmigration zu quantifizieren. Für Wissenschaftler aus den Bereichen Krebsforschung, Wundheilung und Tissue Engineering ist der Wundheilungs-Assay daher ein essenzielles Werkzeug. Das grundsätzliche Prinzip des Scratch Assays besteht darin, dass man in einer dicht gewachsenen Zellschicht mit einem sterilen Instrument, beispielsweise einer Pipettenspitze, einen schmalen Kratzer erzeugt.
Dieser Kratzer bildet eine zellfreie Lücke, die die Forschung als Wundbereich bezeichnet. Im Anschluss daran wird unter kontrollierten Bedingungen beobachtet, wie schnell und in welchem Maße Zellen in diese Lücke einwandern und die ursprüngliche Kontinuität wiederherstellen. Die Geschwindigkeit und Qualität dieses Verschlusses dienen als quantitative Parameter für die Zellmigration. Für die Durchführung eines Scratch Assays werden verschiedene Materialien und Geräte benötigt. Zunächst werden geeignete, adhärente Zelllinien verwendet, die in der Lage sind, monolayerartige Zellschichten zu bilden.
Das richtige Zellwachstumsmedium, ergänzt mit Serum und Antibiotika, sorgt für optimale Bedingungen. Ferner sind sterile Zellkulturplatten die Grundlage, wobei die Wahl der Plattengröße von Experiment zu Experiment unterschiedlich ausfallen kann – häufig genutzt werden 6-, 12- oder 24-Well-Platten, bedingt durch unterschiedliche Anforderungen an die Zellzahl und die Bildgebung. Die Zellen werden zunächst in den Kulturgefäßen ausgesät mit der Zielsetzung, innerhalb von 1 bis 2 Tagen eine komplette, geschlossene Zellschicht zu bilden, die als Ausgangsbasis für den Scratch dient. Die Zellzahl wird präzise bestimmt, meist durch den Einsatz von automatischen Zellzählern oder dem klassischen Hämozytometer, um eine gleichmäßige Besiedlung zu gewährleisten. Eine angemessene Konfluenz ist entscheidend, da sowohl Unter- als auch Überkonfluenz die Zellwanderungsrate negativ beeinflussen können.
Optional kann vor dem Scratch eine Serumsternung vorgenommen werden. Dies bedeutet, dass den Zellen für einige Stunden Serum entzogen wird, um den Zellzyklus zu synchronisieren und dadurch Unterschiede im Zellverhalten besser interpretieren zu können. In manchen Versuchen ist es auch notwendig, die Zellproliferation durch Wirkstoffe wie Mitomycin C zu hemmen. Dadurch wird sichergestellt, dass die Verschlussrate der Lücke hauptsächlich durch Zellmigration erfolgt und nicht durch Zellteilung verfälscht wird. Die Erstellung des Kratzers erfolgt meist mit einer sterilen Pipettenspitze – P10 oder P200 sind üblich – unter strenger steriler Arbeitsweise.
Dabei sollte der Kratzer möglichst gerade und konsistent sein, um vergleichbare Ergebnisse über unterschiedliche Proben zu ermöglichen. Eine gleichmäßige Kratzbreite ist wichtig, da variierende Breiten unterschiedliche Zellwanderungsanforderungen schaffen können. Alternativ existieren speziell entwickelte Geräte wie der CellCut, die eine noch reproduzierbarere und standardisierte Wundschaffung ermöglichen, was vor allem in hochdurchsatzorientierten Laboren von Vorteil ist. Nach dem Kratzen verbleiben Zelltrümmer und abgestorbene Zellen in der Wunde, die sorgfältig durch wiederholtes, sanftes Waschen mit PBS oder serumfreiem Medium entfernt werden sollten, ohne dabei die angrenzenden gesunden Zellen zu beschädigen. Anschließend wird frisches Kulturmedium, gegebenenfalls mit den zu testenden Substanzen, hinzugefügt.
Dabei empfiehlt sich oft, die Serumkonzentration zu reduzieren, um die Proliferation zu minimieren und den Fokus auf die Migration zu legen. Die Beobachtung der Wundheilung erfolgt in Intervallen, die von wenigen Stunden bis zu mehreren Tagen reichen können, abhängig vom Zelltyp und dem Migrationsverhalten. Idealerweise wird dazu ein invertiertes Phasenkontrastmikroskop mit Kamerafunktion verwendet, das die Zellschichten in hoher Auflösung abbildet. Moderne Systeme erlauben sogar eine Live-Cell Imaging-Überwachung, bei der Temperatur, CO2 und Feuchtigkeit konstant gehalten werden, was die physiologischen Bedingungen simuliert und die Präzision der Beobachtung erhöht. Die Auswertung der Migration erfolgt in der Regel durch Bildanalysesoftware wie ImageJ oder CellProfiler.
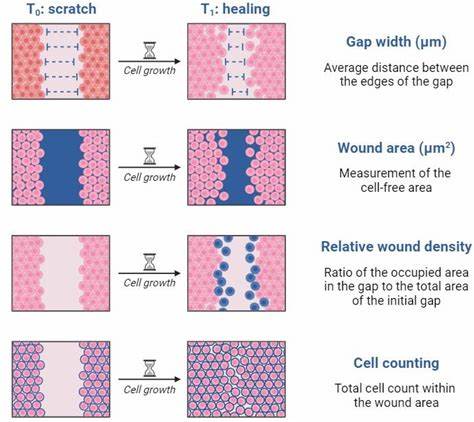
Traditionell wurde die Lückenfläche oder -breite in den Bildern gemessen, um den Versiegelungsprozess zu quantifizieren. Allerdings hat sich die Methode der Relativen Wunddichte (Relative Wound Density, RWD) als fortschrittlicher herausgestellt. Dabei wird nicht nur die schrittweise Füllung der Lücke bewertet, sondern die Zellbesiedlung wird im Verhältnis zur Zellkonzentration außerhalb der Wunde gesetzt. Diese Methode gleicht Effekte wie Zellproliferation oder Schwankungen der Zellzahl in der Monolayerumgebung aus und ermöglicht so eine robustere Interpretation der Migration. Die Berechnung der RWD verlangt eine sorgfältige Abgrenzung der anfänglichen Wund-Region als Region of Interest (ROI) im Bild.
Für jedes Zeitfenster wird dann die Zellbesiedlungsdichte innerhalb und außerhalb dieser ROI bestimmt. Das Verhältnis dieser Werte liefert die RWD, die im Idealfall von einem Wert nahe Null zu Beginn bis hin zu nahe Eins bei vollständiger Schließung der Wunde ansteigt. Durch Vergleich der RWD-Kurven verschiedener experimenteller Behandlungen lassen sich Aussagen über den Einfluss von Medikamenten, Wachstumsfaktoren oder anderen Faktoren auf die Zellmigration treffen. Bei der Durchführung eines Wundheilungs-Assays sind einige Punkte besonders zu beachten, um die Datenqualität zu gewährleisten. Die Zellkonfluenz vor dem Scratch muss möglichst identisch zwischen den Proben sein, da unterschiedliche Ausgangssituationen die Zellwanderung beeinflussen.
Gleichmäßige und reproduzierbare Kratzer reduzieren die Variation in den Ergebnissen. Die Verwendung von Proliferationshemmstoffen oder serumreduzierten Medien minimiert Verfälschungen durch Zellteilung. Regelmäßige und konsistente Bildnahme zur exakt gleichen Position ist essenziell, weshalb Markierungen auf der Plattenunterseite und automatisierte Mikroskopstage genutzt werden. Insgesamt ermöglicht der Wundheilungs-Assay einen tiefen Einblick in die Mechanismen der Zellmigration unter kontrollierten Laborbedingungen. Seine Anwendung ist vielfältig und reicht von der Grundlagenforschung zur Zellbiologie bis hin zur Medikamentenentwicklung und zum Screening potenzieller Wirkstoffe gegen Krebs oder chronische Wunden.
Verbesserte Geräte und fortschrittliche Analysemethoden erhöhen die Reproduzierbarkeit und Aussagekraft dieses klassischen Versuchsaufbaus und machen ihn auch im Zeitalter hochentwickelter Zellmodelle und Minimum-Invasive-Techniken zu einem unverzichtbaren Werkzeug in der biomedizinischen Forschung.