Krebs ist eine der global am meisten gefürchteten Erkrankungen und stellt trotz jahrzehntelanger Forschung nach wie vor eine immense Herausforderung für die Medizin dar. Die Suche nach effektiven Therapien zielt nicht nur auf die direkte Bekämpfung von Tumorzellen, sondern zunehmend auch auf deren Mikroumfeld und die Wechselwirkungen verschiedener Zelltypen. Eine der neuesten und vielversprechendsten Entwicklungen in diesem Bereich ist die Verwendung ingenieurtechnisch modifizierter Adipozyten, also spezialisierter Fettzellen, die gezielt dazu eingesetzt werden, das Tumorwachstum zu unterdrücken. Fettzellen sind weit mehr als nur Energiespeicher. Sie fungieren als aktive Stoffwechselzentren und nehmen eine bedeutende Rolle im zellulären Energiehaushalt ein.
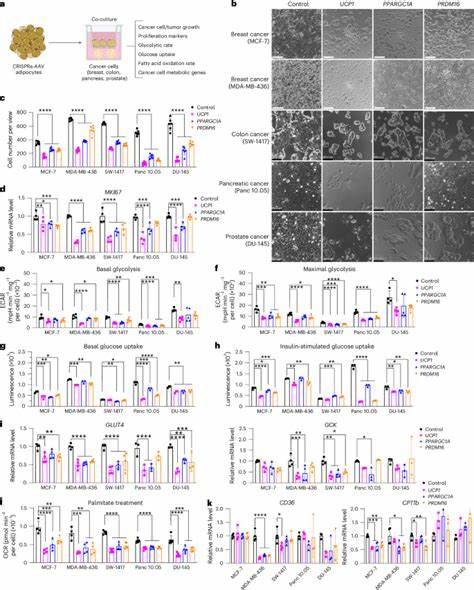
Insbesondere braune und beige Fettzellen verfügen über die Fähigkeit, Energie in Form von Wärme umzuwandeln – ein Prozess, der als Thermogenese bekannt ist. Diese Art von Fettgewebe zeichnet sich durch eine besonders hohe metabolische Aktivität aus, verbraucht große Mengen an Glukose und Fettsäuren und steht daher im Zentrum fortschrittlicher Forschungsansätze. Die neu entwickelten Adipozyten werden mittels moderner Genediting-Technologien so modifiziert, dass sie bestimmte Gene wie UCP1 (Uncoupling Protein 1) hochregulieren. UCP1 ist ein Schlüsselfaktor für die Aktivierung der Thermogenese in braunem Fettgewebe und sorgt für eine erhöhte Stoffwechselrate. Durch diese genetische Aufwertung werden die Adipozyten in die Lage versetzt, vermehrt Glukose und Fettsäuren aufzunehmen und zu verstoffwechseln.
In verschiedenen präklinischen Studien konnte gezeigt werden, dass durch die Implantation dieser modifizierten Adipozyten neben Tumoren, beispielsweise bei Brust- oder Bauchspeicheldrüsenkrebs, das Tumorwachstum signifikant gehemmt wird. Die Mechanismen dahinter beruhen vor allem auf einem Konkurrenzkampf um Nährstoffe zwischen den Tumorzellen und den modifizierten Adipozyten. Da Krebszellen stark auf die Aufnahme von Glukose und Fettsäuren angewiesen sind, um ihr schnelles Wachstum zu unterstützen, führt die verstärkte Aufnahme durch die Adipozyten zu einem Mangel an verfügbaren Ressourcen für den Tumor. Dies wiederum führt zu einer Verringerung der Zellproliferation, erhöhter Apoptose und einer Reduktion von Hypoxie und Angiogenese im Tumorgewebe. Darüber hinaus ist die so genannte adipose manipulation transplantation (AMT) nicht nur in Zellkultur-Experimenten erfolgreich, sondern auch in Tiermodellen überzeugend demonstriert worden.
In genetisch modifizierten Mäusen mit erblich bedingtem Brust- oder Bauchspeicheldrüsenkrebs konnten implantierte braun-ähnliche Adipozyten das Tumorprogress effektiv verlangsamen. Interessanterweise zeigten diese organischen Fettzellstrukturen nicht nur eine hemmende Wirkung, wenn sie direkt neben dem Tumor platziert wurden, sondern auch bei Implantationen in entfernten Körperregionen, was auf eine systemische Wirkung hindeutet. Ein weiterer Pluspunkt der AMT-Technologie ist die Anpassungsfähigkeit und Steuerbarkeit. Durch die Nutzung eines so genannten Induktionssystems mittels Tetracyclin kann die Aktivität und damit der Stoffwechsel der modifizierten Adipozyten gezielt ein- und ausgeschaltet werden. Zusätzlich wurde ein innovatives Zellgerüst-Implantatsystem entwickelt, das es ermöglicht, die Fettzellorganoide in einem biokompatiblen Mikrowellengerüst zu verankern und dadurch die Transplantation zu erleichtern sowie im Bedarfsfall auch wieder zu entfernen oder auszutauschen.
Die Möglichkeiten zur individualisierten Behandlung sind ebenfalls bemerkenswert. So kann die AMT an verschiedene Krebsarten und deren spezifische metabolische Eigenschaften angepasst werden. Ein Beispiel ist die Hochregulierung des Enzyms Uridinphosphorylase 1 (UPP1) in Adipozyten, das bei der Behandlung von Bauchspeicheldrüsenkrebs eingesetzt wurde, der auf Uridin als Nährstoff angewiesen ist. Dieses zeigt, wie flexibel das Prinzip der AMT auf unterschiedliche Tumorstoffwechselwege zugeschnitten werden kann. Die klinische Anwendung dieser neuen Therapieform ist bereits absehbar, da viele der eingesetzten Verfahren in der Plastischen und Rekonstruktiven Chirurgie, wie Liposuktion und Fettgewebetransplantation, sich bereits im Alltag etabliert haben und über robuste Sicherheitsprofile verfügen.
Die ex vivo Manipulation von Patienten-eigenem Fettgewebe bietet zudem eine niedrige immunologische Barriere und könnte so personalisierte und gut verträgliche Therapien ermöglichen. Neben der direkten Hemmung des Tumorwachstums wirken die modifizierten Adipozyten auch auf den systemischen Stoffwechsel ein. So wurden in Tiermodellen verbesserte Glukosetoleranz und Insulinsensitivität beobachtet sowie eine Verringerung der Insulinspiegel im Blut. Da Insulin ein bekannter Wachstumsfaktor für Krebszellen ist, trägt dieser metabolische Effekt zusätzlich zur Tumorsuppression bei. Auch wenn die Ergebnisse bislang überwiegend präklinischen Charakter besitzen, deuten sie auf eine vielversprechende neue Richtung im Kampf gegen Krebs hin.
Zusätzlich zur AMT werden weitere Studien notwendig sein, um die Langzeitwirkungen, richtige Dosierung, Verträglichkeit und mögliche Begleittherapien zu definieren. Die Kontrolle der Muskel- und Fettmasse wird bei längerer Anwendung, insbesondere im Hinblick auf ein mögliches Cachexia-Risiko, begleitet werden müssen. Die Kombination von moderner Genom-Editierung, Zelltherapie und präziser medikamentöser Steuerung macht die AMT zu einem zukunftsweisenden Konzept. Durch die Fähigkeit, Tumorzellen über deren Energielieferanten gezielt auszubremsen und gleichzeitig den Stoffwechsel des gesamten Organismus günstig zu beeinflussen, bietet diese Methode einen Mehrwert, der über klassische Chemotherapien hinausgeht. Zusammenfassend lässt sich sagen, dass die Implantation von genetisch modifizierten Adipozyten als innovative Therapieform die Tumorprogression in verschiedenen Krebsmodellen signifikant hemmen kann.
Dieses Verfahren setzt auf die metabolische Konkurrenz und den gezielten Ressourcenentzug im Tumormikromilieu, um die Krebszellen zu schwächen und zum Absterben zu bringen. Die Vielseitigkeit, Steuerbarkeit und schon bestehende klinische Infrastrukturen zur Anwendung von Fettzelltransplantationen bieten eine reale Chance, AMT künftig in die klinische Onkologie zu integrieren und damit das Spektrum der Krebsbehandlung zu erweitern.