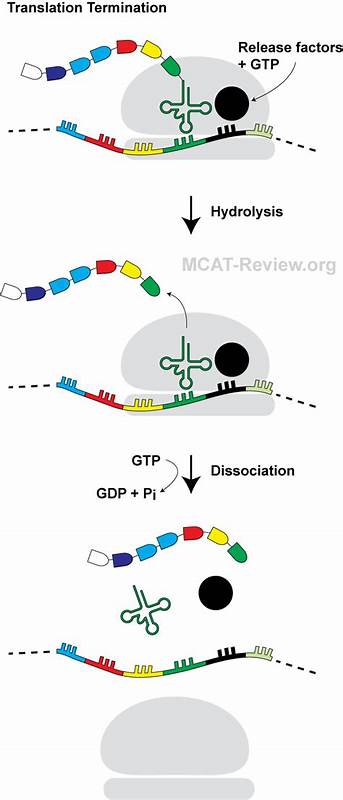
Die Proteinsynthese ist eine fundamentale zelluläre Funktion, die genetische Informationen in funktionelle Proteine umsetzt. Zentraler Akteur dieses komplexen Prozesses ist die Ribosomale Maschinerie, die mRNA-Sequenzen ausliest und Aminosäuren zu einer wachsenden Peptidkette verknüpft. Die Translation durchläuft verschiedene Phasen: Initiation, Elongation und Termination. Letztere erfolgt, wenn das Ribosom auf eines der drei Stoppcodons trifft, was die Freisetzung des neu synthetisierten Proteins signalisiert. Diese Termination wird von spezifischen Freisetzungsfaktoren (RF) gesteuert, die am Peptidyl-Transferase-Zentrum (PTC) des Ribosoms wirken.
New Insights bergen jedoch, dass dieser Prozess nicht immer so unkompliziert verläuft, wie lange angenommen. Im Verlauf der letzten Jahre sind sogenannte Ribosom-Stall-Peptide (Arrest Peptides, RAPs) in den Fokus der Forschung gerückt. Diese kurzen, naszierenden Peptide können im Austrittstunnel des Ribosoms eine Interaktion eingehen, die den normalen Translationverlauf hemmt oder ganz stoppt. Sie wirken oft als genetische Feedback-Mechanismen und regulieren die Expression nachgeschalteter Gene, indem sie das Fortschreiten der Ribosomen beeinflussen. Bekannte Beispiele wie TnaC in Escherichia coli demonstrieren eine Abhängigkeit von zellulären Metaboliten – im Fall von TnaC ist das das Aminosäurederivat Tryptophan, welches als Arrestinduziertor wirkt.
In einem kürzlich veröffentlichten wissenschaftlichen Durchbruch wurde ein neuartiges miniaturisiertes RAP namens PepNL entdeckt, das einen eigenständigen und bisher unbekannten Mechanismus verwendet, um die Translationstermination zu blockieren. Dieses Peptid, bestehend aus nur 14 Aminosäuren, entwickelt im Ribosomentunnel eine einzigartige Mini-Haarpin-Struktur, die die Aktivität des Freisetzungsfaktors RF2 auf besondere Weise hemmt. Die Erforschung von PepNL begann mit einer systematischen Suche nach bislang uncharakterisierten kleinen offenen Leserahmen (sORFs) in Escherichia coli, die potenzielle RAP-Aktivität besitzen. Die methodische Grundlage bildeten eine Kombination aus Phänotypanalyse, Massenspektrometrie von Peptidyl-tRNA-Komplexen und Cryo-Elektronenmikroskopie (Cryo-EM). Dabei wurden zwei Kandidaten identifiziert: PepNL und NanCL.
Fokus lag insbesondere auf PepNL aufgrund seiner starken zellulären Auswirkungen. Strukturelle Aufbereitung des ribosomalen Arrests durch PepNL mittels hochauflösender Cryo-EM zeigte, dass das Peptid sich nicht wie üblich vom ribosomalen Peptidyl-Site (P-Site) zum Tunnelausgang orientiert, sondern der N-Terminus unerwartet rückwärts in Richtung des Tunnel-Eingangs gefaltet ist. Dieser Miniatur-Haarpin besteht aus einer kompakten Faltung, die durch intramolekulare hydrophobe Wechselwirkungen stabilisiert wird – beispielsweise zwischen Isoleucin 3 und Tyrosin 9, sowie intermolekulare Interaktionen mit spezifischen 23S rRNA-Nukleotiden. Die Folge dieser Konfiguration ist eine Verzerrung des C-terminalen Peptidsegments, insbesondere der Isoleucin 13, der sich in einem für die Termination kritischen Bereich des PTC platziert. Unter physiologischen Bedingungen bindet der Freisetzungsfaktor RF2 an das Ribosom, erkennt das UGA-Stoppcodon und positioniert das für die Esterbindungs-Hydrolyse essenzielle GGQ-Motiv in der Peptidyl-Transferase-Zentrumstasche.
Im Fall von PepNL jedoch führt die veränderte Konformation des Peptids zu einem sterischen Zusammenstoß zwischen der Isoleucin 13-Seitenkette und Gln 252 des GGQ-Motivs. Diese Blockade verhindert eine korrekte Einfügung des GGQ-Motivs und hemmt somit die Freisetzung der naszierenden Polypeptidkette. Die Relevanz dieser mechanistischen Beobachtung wird durch die konformative Reorganisation von RF2 deutlich: Das Apikalloop innerhalb von Domäne III des Proteins zeigt nach Interaktion mit PepNL eine deutlich verschobene, inaktive Konformation, die über zusätzliche Wasserstoffbrücken mit der 23S rRNA stabilisiert wird. Die gesamte Domäne erscheint um etwa 3 Å in Richtung L1-Schleife verschoben – ein Zustand, der für eine funktionelle Termination ungeeignet ist. Mutagene Analysen unterstützten, dass insbesondere die Isoleucin 13 eine Schlüsselrolle bei der Hemmung spielt, da eine Ersetzung durch Alanin den Arrest vollständig aufhebt.
Im Gegensatz zu bereits bekannten metabolitsensitiven Arrest-Peptiden, die externe Molekül-Induktoren benötigen, agiert PepNL intrinsisch und benötigt keinen solchen Auslöser zur Translationarrestierung. Erstaunlicherweise wurde jedoch festgestellt, dass die Translation am Stoppcodon von PepNL abhängig von der Verfügbarkeit der Aminosäure Tryptophan moduliert wird. Insbesondere bewirkt die Anwesenheit von Trp-tRNATrp ein sogenanntes Read-through am UGA-Stoppcodon, wodurch die Hemmung durch PepNL aufgehoben wird. In Abwesenheit von Tryptophan fiel der Arrest deutlich stärker aus. Mechanistisch bedeutet dies, dass bei ausreichender Tryptophanversorgung die ribosomale Maschinerie in der Lage ist, das Stoppcodon zu überbrücken, indem die Tryptophan-spezifische tRNA das Stoppcodon dekodiert und die Translation somit fortsetzen kann.
Interessanterweise stört die gefaltete Mini-Haarpin-Struktur des Peptids offenbar die effiziente Bindung sowohl von RF2 als auch von Trp-tRNATrp, was darauf hindeutet, dass das Timing der Haarpinfaltung für die Regulation des Arrests entscheidend ist. Die Annahme ist, dass das Peptid zunächst ohne feste Faltung translatiert wird und bei Verzögerung durch schnelle Read-through-Mechanismen noch nicht zum Arrest kommt. Sollte sich jedoch die Mini-Haarpin-Faltung vor dem Read-through etablieren, kann weder die Termination noch das Überspringen des Stoppcodons effizient erfolgen, was zu einem dauerhaften Halt führt. Die regulatorische Bedeutung von PepNL wird noch durch seine genetische Lage hervorgerufen: Seine Translation beeinflusst die Expression des unmittelbar nachfolgenden pepN-Gens, das ein Aminopeptidase kodiert und in der zellulären Aminosäure-Recycling- und Abbauprozessen eine Rolle spielt. Diese Überlappung veranschaulicht, wie kleine Peptide durch Translationarrest eine präzise Kontrolle über wichtige metabolische Prozesse ausüben können.
Die Entdeckung des miniaturisierten Haarpin-Peptids PepNL und dessen einzigartiger Mechanismus zur Störung der Translationstermination erweitert das Spektrum der bekannten molekularen Strategien, mit denen naszierende Peptide die Expression regulieren. Es verdeutlicht, dass selbst sehr kurze Peptidsequenzen komplexe räumliche Strukturen ausbilden und gezielt mit der Ribosomenmaschinerie interagieren können, um kritische Funktionen wie die Termination zu modulieren. Langfristig bieten diese Erkenntnisse einen wichtigen Rahmen für die Entwicklung neuer antibiotischer Strategien, die gezielt die Translationstermination beeinflussen könnten. Zudem eröffnen sie Perspektiven für das synthetische Design von Peptiden, die Durchfluss und Entwicklung von Proteinsynthese in Bakterien präzise steuern. Die Regulierung durch stopcodon-Read-through in Abhängigkeit von Aminoacyl-tRNA-Verfügbarkeit stellt ein bisher kaum untersuchtes Steuerungselement dar, das für die Anpassung an wechselnde Umweltbedingungen von großer Bedeutung sein könnte.
Zusammenfassend lässt sich festhalten, dass die Erforschung von PepNL in mehrfacher Hinsicht wegweisend ist: Die Kombination aus struktureller Biologie, Molekularbiologie und Proteomik zeigt eindrücklich, wie hochkomplexe Regelkreise selbst in der scheinbar einfachen Bakterienzelle wirken. Die miniaturisierte Haarpin-Struktur als Schlüssel zur Hemmung der Translationstermination ist eine bemerkenswerte Innovation der Natur, die unser Verständnis der Proteinbiosynthese vertieft und wertvolle Impulse für biotechnologische und pharmakologische Anwendungen liefert.