Krebs zählt zu den herausforderndsten Krankheiten unserer Zeit, insbesondere wenn es um aggressive und schwer therapierbare Formen geht. Trotz großer Fortschritte in der Medizin bleiben viele Krebsarten, vor allem solche bei Kindern, weiterhin eine schwere Belastung für Betroffene und ihre Familien. Ein innovativer Ansatz, der zunehmend an Bedeutung gewinnt, sind sogenannte Protein-Slayer oder PROTACs – molekulare Wirkstoffe, die gezielt krankheitsverursachende Proteine im Körper vernichten. Diese Technologie verspricht, einige der bösartigsten Krebserkrankungen effektiver zu bekämpfen und die Behandlungsperspektiven deutlich zu verbessern. Die herkömmliche Krebstherapie basiert oft auf Chemotherapie, Bestrahlung oder medikamentösen Blockaden bestimmter Proteine, welche die Krebszellen am Wachstum hindern sollen.
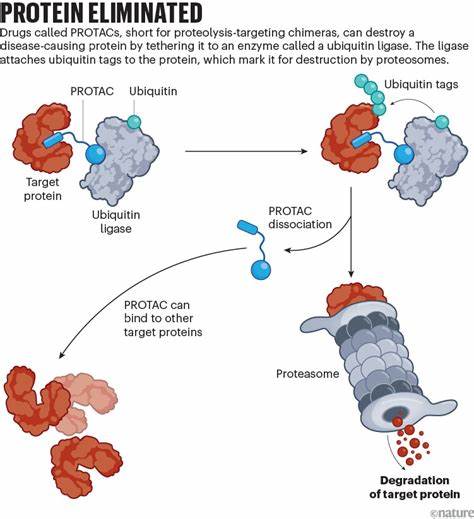
Hierbei wirken die Medikamente meist als Inhibitoren, blockieren also die aktive Stelle eines Proteins und verhindern so dessen Funktion. Dieser Ansatz stößt jedoch häufig an seine Grenzen, weil viele der entscheidenden Proteine im Krebs als „undruggable“ gelten. Diese „unantastbaren“ Proteine bieten keine klassischen Bindungstaschen für Medikamente, weshalb sie mit herkömmlichen Wirkstoffen kaum kontrolliert werden können. PROTACs, kurz für Proteolysis-Targeting Chimeras, revolutionieren diesen Ansatz. Sie nutzen das körpereigene Protein-Abbausystem, um gezielt krankheitsverursachende Proteine nicht nur zu blockieren, sondern komplett abzubauen.
Dies geschieht durch die Verbindung des Zielproteins mit einer Enzymkomponente, die das Protein markieren und orchestrieren kann, damit es von der Zelle entsorgt wird. Man kann sich das wie eine Art molekularen „Kuss des Todes“ vorstellen, der dem Protein den Garaus macht. Diese einzigartige Wirkungsweise erweitert das Repertoire möglicher Zielstrukturen enorm und ermöglicht den Kampf gegen Proteine, die bislang als unantastbar galten. Eine der größten Herausforderungen bei der Entwicklung von PROTACs war es, diese Moleküle so zu gestalten, dass sie in die Zellen eindringen und dort effektiv arbeiten können. Die Herstellung kleiner und zugleich wirksamer PROTACs erfordert komplexe biochemische Techniken.
Nach anfangs skeptischen Reaktionen in der Wissenschaftsgemeinschaft konnten Forscher im Jahr 2015 bahnbrechende Studien veröffentlichen, die das enorme Potenzial dieser Substanzen verdeutlichten. Von da an war klar, dass PROTACs kein bloßer Labor-Trick bleiben, sondern eine neue Ära der Medikamentenentwicklung einläuten. Besonders vielversprechend sind PROTACs bei der Behandlung von Kinderkrebsarten wie Neuroblastom, einem der häufigsten soliden Tumore im Kindesalter, der oft schwer zu therapieren ist und besonders aggressive Verläufe nimmt. Ein bewegendes Beispiel aus der medizinischen Praxis ist die Geschichte von Evan Lindberg, der mit nur drei Jahren an Neuroblastom erkrankte. Trotz intensiver Therapie erlag Evan seiner Krankheit mit sieben Jahren.
Sein Schicksal führte dazu, dass medizinische Experten wie die Pädiatrische Onkologin Yael Mossé ihren Fokus auf innovative Behandlungsformen richteten, darunter auch die Entwicklung von PROTACs, die auf bisher unadressierbare Proteine abzielen. Ein besonders wichtiger Tumor-Treiber bei Neuroblastom ist das Protein MYCN, ein sogenannter Transkriptionsfaktor, der Gene zur Zellvermehrung aktiviert. Individuen mit einer Überexpression von MYCN haben deutlich schlechtere Prognosen, da dieser Faktor das Wachstum und die Aggressivität der Tumore anheizt. Klassiker wie kleine Moleküle oder Antikörper konnten MYCN bisher nicht wirkungsvoll bekämpfen, weil Transkriptionsfaktoren oft keine geeigneten Angriffspunkte bieten. PROTACs könnten genau hier die Lösung sein und MYCN gezielt eliminieren, wodurch die Krebszellen ihre Wachstumsumgebung verlieren würden.
Die Entwicklung neuer Medikamente gegen bislang „undruggable“ Proteine ist jedoch mit Risiken und Herausforderungen verbunden. Die Forschungsprojekte wie das „KOODAC“-Team (Knocking Out Oncogenic Drivers and Curing Childhood Cancers) arbeiten daher eng mit Wissenschaftlern aus aller Welt und Patientenvertretern zusammen, um passende PROTAC-Kandidaten zu finden. Ihr Ziel ist es, Produkte zu schaffen, die nicht nur effektiv, sondern auch bezahlbar und gut verträglich sind, da viele Familien besonders in einkommensschwächeren Ländern oft auf eine teure Behandlung verzichten müssen. Neben Kinderkrebs wird die PROTAC-Technologie bereits bei erwachsenen Krebserkrankungen intensiv erforscht. Mehrere PROTAC-Kandidaten befinden sich bereits in fortgeschrittenen klinischen Prüfungen, darunter Wirkstoffe, die das Östrogen-Rezeptor-Protein bei Brustkrebs oder den Androgen-Rezeptor bei Prostatakrebs angreifen.
Erste Studien zeigen sogar, dass diese Proteindegrader teilweise bessere Wirksamkeit aufweisen als herkömmliche Blocker, insbesondere bei Tumoren, die gegen frühere Therapien resistent geworden sind. Darüber hinaus könnten PROTACs in Zukunft auch bei anderen Krankheiten eingesetzt werden, die durch fehlregulierte Proteine hervorgerufen werden. Parkinson, entzündliche Erkrankungen oder bestimmte Schmerzsyndrome gehören zu den Gebieten, die von der Aufklärung der Proteinfunktion und deren selektiver Eliminierung profitieren könnten. Die Perspektiven für die Protein-Slayer-Medikamente sind vielversprechend, doch es gilt auch realistischerweise anzuerkennen, dass Krebs ein sehr vielschichtiges und anpassungsfähiges Problem darstellt. Experten wie Charles Mullighan von St.