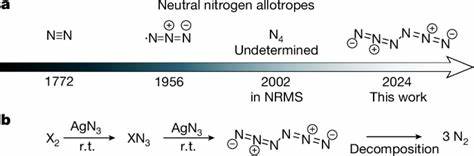
Stickstoff ist eines der häufigsten Elemente auf der Erde und die Hauptkomponente unserer Atmosphäre in Form des stabilen Moleküls N2. Bislang galt molekularer Stickstoff ausschließlich in der diatomaren Form als natürlich und stabil existierend. Dennoch ist die Forschung auf dem Gebiet der Stickstoff-Allotrope – also unterschiedlicher struktureller Formen des Elements – seit langem von Interesse, insbesondere wegen ihres bemerkenswert hohen Energieinhalts und der Umweltfreundlichkeit ihrer Zersetzung. Die Synthese neutraler Stickstoff-Allotrope über das einfache N2 hinaus galt bislang als extrem herausfordernd. Die kürzlich publizierte Herstellung des neutralen Hexanitrogens C2h-N6 stellt daher einen bedeutenden Durchbruch dar, der das Potenzial besitzt, die Entwicklung neuer Hochenergie-Materialien maßgeblich voranzutreiben.
Das Hexanitrogen (N6) wurde erstmals experimentell durch die Reaktion von Chlor- oder Bromgas mit Silberazid (AgN3) bei Raumtemperatur hergestellt. Dieses Verfahren ermöglicht in der Folge die Kryogenisolierung des Produkts in Argon-Matrizen bei äußerst niedrigen Temperaturen (10 Kelvin) sowie die Kondensation von reinem N6 als Film bei flüssigem Stickstofftemperatur (77 Kelvin). Die Stabilität dieses neutralen Allotrops unter solch relativ milden Bedingungen übertrifft alle bisherigen Erwartungen und widerlegt die bisherige Annahme, dass höhere neutrale Stickstoffmoleküle unvermeidlich extrem instabil sind.Die experimentelle Bestätigung der Existenz von N6 erfolgte über umfangreiche Spektroskopien, einschließlich Infrarot- und UV-Vis-Analysen, ergänzt durch Isotopen-Labeling-Studien mit 15N, was zur eindeutigen Identifikation der molekularen Struktur beitrug. Darüber hinaus wurden modernste quantenchemische Rechnungen (ab initio) vorgenommen, um die Konformationen, Bindungsverhältnisse und das potentielle Energieprofil des Moleküls zu untersuchen.
Die Untersuchungen zeigen, dass das Molekül eine C2h-Symmetrie aufweist und aus zwei zusammengebundenen Azid-Gruppen besteht, deren Bindungslänge und Elektronenverteilung auf teilweise Doppelbindung hinweisen. Dabei ist das zentrale N–N-Bindungspaar anders als ursprünglich vermutet kein Brennpunkt für schnellen Zerfall, was zu einer relativ hohen kinetischen Stabilität beiträgt.Die kinetische Stabilität wurde durch Berechnungen der Aktivierungsbarriere für den Zerfall in drei Moleküle N2 quantifiziert. Mit einem Barrierenwert von ungefähr 14,8 kcal/mol, unterstützt von Analysen zur quantenmechanischen Tunnelung, besitzt das Hexanitrogen eine Lebensdauer, die selbst bei höheren Temperaturen die kryogene Isolation ermöglicht. Dies ist insofern bemerkenswert, als dass andere hypothetische Stickstoff-Allotrope wie Hexazin (cyklisches N6) durch Tunnelprozesse deutlich schneller zerfallen und deshalb experimentell schwer zu fassen sind.
Der energetische Gehalt des N6-Moleküls liegt Schätzungen zufolge bei etwa dem Zweifachen des von TNT pro Gewichtseinheit freigesetzten Energiewerts, womit es eines der potentesten bekannten energiereichen Materialien darstellt. Seinerseits zerfällt Hexanitrogen bei der Detonation ausschließlich in unschädliches molekulares Stickstoffgas, was es zu einer umweltfreundlichen Alternative für verschiedene technische Anwendungen wie Treib- und Sprengstoffe macht.Der synthetische Weg über die Reaktion von Silberazid mit Halogenmolekülen nutzt die hohen Reaktivitäten dieser Reaktanten gezielt aus, um das lange gesuchte N6-Molekül zu generieren. Die Gefahren bei der Verwendung von Silberazid und Halogenaziden erfordern strenge Sicherheitsmaßnahmen, dennoch wurde die Reaktion bei Raumtemperatur unter reduzierten Drücken realisiert, was die praktische Umsetzbarkeit unter Laborbedingungen unterstreicht.Die Spektroskopie liefert eindeutige Fingerabdrücke für die Anwesenheit von Hexanitrogen.
Bandsignale im Infrarotbereich bei spezifischen Wellenzahlen sind charakteristisch für die asymmetrischen Streckschwingungen der Azid-Gruppen und ihre Kopplungen. Die Verschiebungen der Banden bei Isotopenaustausch mit 15N bestätigten die Zuordnung der molekularen Struktur. Die optische Absorption im UV-Bereich korreliert zudem sehr gut mit den berechneten elektronischen Übergängen, was die Erkenntnisse weiter untermauert.Porträt einer bemerkenswerten Verbindung: Hexanitrogen übertrifft sogar bekannte polynitrogene Ionenverbindungen, deren Synthesen bislang unter hohem Aufwand und unter Nutzung spezieller Salze erfolgten. Dagegen liefert die neutrale Form von N6 einen neuartigen Zugang zu Stickstoffverbindungen mit hoher Energie und relativ hoher Stabilität.
Sie schlägt damit eine Brücke zwischen der aufwendig herzustellenden ionischen Chemie und der natürlicher vorkommenden molekularen Formen.Die theoretischen Berechnungen des Elektronendichteverlaufs zeigten, dass die Bindungen innerhalb des N6-Moleküls keine einfachen Single- oder Dreifachbindungen sind, sondern eine komplexe Verteilung von positiven und negativen Ladungen aufweisen. Diese Struktur führt zu einer beträchtlichen Barriere für den Zerfall in kleinere Stickstoffmoleküle oder Radikale und erklärt damit die beobachtete Stabilität.Die Entdeckung von Hexanitrogen könnte weitreichende Konsequenzen für die Materialwissenschaft haben. Hochenergetische Materialien, die nur Stickstoff als Zerfallsprodukt hinterlassen, bieten eine saubere Alternative zu aminesubstituierten Spreng- und Treibstoffen, die oft umweltschädliche Nebenprodukte erzeugen.
Zudem könnten solche Verbindungen in kleinen Mengen als Energiespeicher oder als Ausgangsmaterial für die Synthese anderer neuartiger Stickstoffverbindungen dienen.Auch in der Grundlagenforschung ist die Existenz und charakteristische Stabilität von N6 faszinierend. Das Molekül stellt ein Beispiel dar, wie chemische Bindungen und molekulare Formen sich jenseits der gewöhnlichen Vorstellungen entfalten können. Seine Synthese öffnet neue Perspektiven für zukünftige Studien zur Erforschung von Stickstoffnetzwerken und zur Schranke der Stabilität neutraler polynitrogener Moleküle.Das Forschungsprojekt wurde von einem Team um Weiyu Qian, Artur Mardyukov und Peter R.