Die Interaktion zwischen physikalischen Reizen und zellulären Prozessen stellt ein faszinierendes Forschungsfeld dar, das in den letzten Jahren zunehmend an Bedeutung gewonnen hat. Besonders die akustische Modulation, also die Beeinflussung biologischer Systeme durch Schallwellen im hörbaren Frequenzbereich, hat sich als ein unerwartet wirkungsvoller Stimulus herausgestellt. Mechanosensitive Gene – jene Gene, die auf mechanische Reize reagieren – spielen dabei eine tragende Rolle. Neueste wissenschaftliche Untersuchungen haben gezeigt, dass gezielte Schallanregungen nicht nur die Expression solcher Gene verändern können, sondern auch fundamentale Auswirkungen auf die Differenzierung von Adipozyten, den Fettzellen, ausüben. Diese Erkenntnisse eröffnen neue Perspektiven in der Zellbiologie, Medizin und Biotechnologie.
Schall als biologischer Stimulus wird lange Zeit vor allem im Kontext von Hörfunktionen oder Muskelreflexen betrachtet. Doch akustische Wellen sind im Grunde mechanische Druckwellen, die sich in unterschiedlichen Medien ausbreiten und dabei physikalische Kräfte auf Zellen übertragen können. Die natürlichen Lautstärken und Frequenzbereiche, die innerhalb des menschlichen Körpers und anderer Lebewesen vorhanden sind, liegen meist im Bereich von 20 Hz bis 20 kHz, also dem hörbaren Bereich für Menschen. Geräusche innerhalb dieses Spektrums erzeugen dabei Druckamplituden, die in Geweben Werte bis in den Bereich von mehreren tausend Pascal erreichen können. Offiziell galt lange, dass solche schwachen akustischen Einwirkungen keine direkten zellulären Antworten hervorrufen.
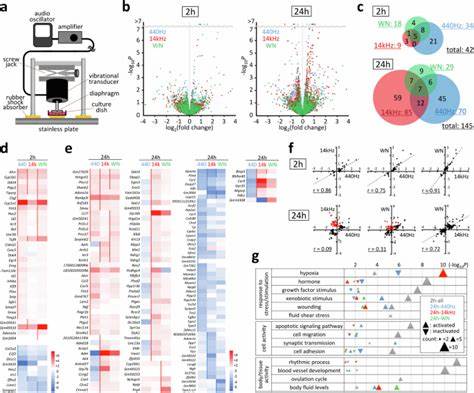
Die aktuellen Studien widerlegen diese Annahme eindrucksvoll und zeigen, dass Zellen Schall als einen echten mechanischen Stimulus wahrnehmen und darauf reagieren. Die entscheidende Rolle mechanosensitiver Gene in diesem Prozess entspringt ihrer Fähigkeit, geschlossen mit molekularen Sensoren und Signalkaskaden zu interagieren. Mechanosensitive Gene wie Ptgs2 (Prostaglandin-Endoperoxid-Synthase 2, auch als Cyclooxygenase-2 bekannt) oder Ctgf (Connective Tissue Growth Factor) verändern ihre Expression als Antwort auf mechanische Induktion. Untersuchungen mit murinen C2C12-Myozyten haben gezeigt, dass bereits nach kurzer akustischer Stimulation von nur zwei Stunden bei nominal 100 Pascal akustischem Druck über Signale von 440 Hertz, 14 Kilohertz oder sogar Weißem Rauschen eine Vielzahl von Genen bis zu 42 unterschiedlich exprimiert wird. Bei längerer Einwirkzeit von 24 Stunden werden sogar 145 Gene mit veränderten Expressionsmustern identifiziert, was die nachhaltige Wirkung der akustischen Modulation unterstreicht.
Diese Genantworten sind dabei nicht uniform, sondern weisen eine komplexe Dynamik auf. Einige Gene reagieren schnell und transient mit einem typischen „Spitzenmuster“, kehren also nach einem initialen Anstieg wieder zum Normallevel zurück. Andere zeigen eine längerfristige, persistent veränderte Expression, was auf eine dauerhafte Modulation der Zellfunktion hindeutet. Diese Differenzierung spiegelt sich auch in der beteiligten Signaltransduktion wider. So ist die Aktivierung des Fokalen-Adhäsions-Kinase (FAK)-Signalwegs essenziell für die Übermittlung des akustischen Stimulus.
FAK wird durch Phosphorylierung am Tyrosin-397 aktiviert, was auf eine mechanische Verstärkung der Zelladhäsion und -migration hinweist. Mittels dieser Signalwege werden Modulationen in der Genexpression eingeleitet, die unter anderem die Synthese von Prostaglandin E2 (PGE2) über Ptgs2 erhöhen. PGE2 ist ein zentraler mediatorischer Faktor, der nicht nur Entzündungsprozesse reguliert, sondern auch für die Differenzierung und Funktion von Adipozyten eine Schlüsselrolle spielt. Interessanterweise zeigen Untersuchungen mit 3T3-L1 Präadipozyten – einem etablierten Modell zur Erforschung der Fettzellendifferenzierung – dass akustische Stimulation dieser Zellen deren Entwicklung erheblich hemmt. Sowohl kontinuierliche als auch periodische Schallanregungen über den Zeitraum der frühen Differenzierung führen zu einer signifikanten Senkung der Expression adipogener Marker wie Cebpa und Pparg.
Diese Gene sind maßgeblich für die Reifung von Fettzellen verantwortlich. Parallel dazu werden die Lipidakkumulation in den Zellen vermindert, was auf eine funktionelle Auswirkung der akustischen Modulation hinweist. Dass PGE2 und der EP4-Rezeptor-Signalweg maßgeblich an dieser Unterdrückung beteiligt sind, wird durch pharmakologische Eingriffe bestätigt. So kann der Einsatz von L161.982, einem EP4-Rezeptor-Antagonisten, die durch akustische Stimulation induzierten Genmodulationen blockieren.
Gleichzeitig unterstreicht die Erhöhung von PGE2 im Medium ohne Schallapplikation eine Übertragbarkeit der Effekte durch Botenstoffsekretion. Die Zellantworten auf Schall sind zugleich stark abhängig von der physikalischen und zellulären Umgebung. Die Zelldichte beeinflusst beispielsweise das Ausmaß und die Richtung der Genregulation. Auch die Art der Schallwelle – ob Sinus, Dreieck oder Rechteck – modifiziert die Antwortmuster leicht, was vermutlich an der Überlagerung und dem Vorhandensein von Oberwellen liegt. Unterschieden wird außerdem der direkte Soundkontakt gegenüber indirekter Schallübertragung durch Medium und Haltestruktur.
Direkte Übertragung mittels Vibrationswandler im Medium führt zu stärkeren und klareren Antworten als über Lautsprecher, die Komplexe Schall- und Vibrierfelder erzeugen. Auf morphologischer Ebene führen akustische Reize zu dynamischen Veränderungen in der Zellform und vergrößerten Zelladhäsionsflächen mit charakteristischen Lamellipodien. Diese Erscheinung lässt darauf schließen, dass Schall nicht nur passiv wahrgenommen wird, sondern aktiv zelluläre Strukturen mobilisiert und reorganisiert. Viele mechanosensitive Gene sind zudem eng in Signalnetzwerke eingebunden, die auch für Zellwanderung, Überleben und Differenzierung entscheidend sind. Die Spezifität der akustischen Reaktion variiert stark zwischen Zelltypen.
Muskel- und Bindegewebszellen mit hochentwickelten Fokaladhäsionen, wie Myoblasten oder Fibroblasten, zeigen die stärksten Genexpressionsänderungen und biochemischen Reaktionen auf Schall, während epithelialen oder neuroblastischen Zellen vergleichsweise wenig reagieren. Diese Unterschiede werden mit der Variabilität der mechanosensorischen Anlagen und Zelladhäsion erklärt. Ein spannendes Nebenprodukt all dieser Forschung ist die mögliche Anwendung der akustischen Modulation in biomedizinischen Kontexten. Da Adipozytendifferenzierung wesentlich für Fettgewebeentwicklung, Stoffwechselregulation und damit auch für Krankheiten wie Adipositas oder metabolisches Syndrom ist, bieten akustische Reize potenzielle neue therapeutische Ansatzpunkte. Die vergleichsweise schonende Nicht-Invasivität sowie das Fehlen von medikamentösen Nebenwirkungen machen Schall besonders attraktiv.
Darüber hinaus sind vielfältige Anwendungen denkbar. So könnte akustische Stimulation bei der Gewebezüchtung, beispielsweise in der regenerativen Medizin, genutzt werden, um Zelltrennung, Proliferation und Differenzierung gezielt zu steuern. Auch in der Mikrobiologie, Krebsforschung oder Neurowissenschaften ließen sich Manipulationen des Zellverhaltens durch Schall erforschen und ggf. therapeutisch einsetzen. Abschließend lässt sich festhalten, dass Schall als physikalischer Reiz für Zellen weit mehr ist als ein bloßes Nebenprodukt der Umwelt.
Die akustische Modulation mechanosensitiver Gene demonstriert eindrucksvoll, wie Lebewesen über Jahrmillionen Reaktionsmechanismen auf Druckwellen entwickelt haben. Ein tieferes Verständnis dieser Wege wird zukünftige Innovationen in Biowissenschaften und Medizin ermöglichen sowie unsere grundlegende Sicht auf Zellbiologie und Umweltinteraktionen erweitern. Studien dieser Art stellen den Beginn einer neuen Ära dar, in der das Zusammenspiel von Schall und Leben auf molekularer und zellulärer Ebene intensiv erforscht und genutzt wird.