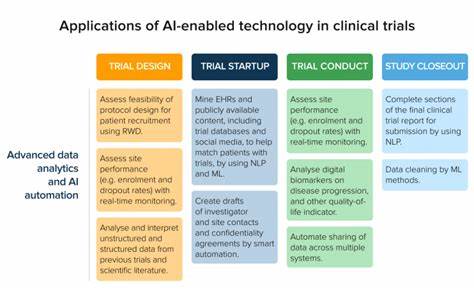
Die Arzneimittelentwicklung zählt zu den komplexesten und risikoreichsten Industrien weltweit. Der Prozess, in dem neue Wirkstoffe vom Labor bis zum Patient gelangen, umfasst zahlreiche Phasen – angefangen bei der präklinischen Forschung bis hin zu den klinischen Studien. Gerade die klinische Entwicklungsphase unterscheidet sich dabei in ganz wesentlichen Punkten von der präklinischen Forschung. Zwar sind die Hoffnungen auf den Einsatz von Künstlicher Intelligenz (KI) in allen Bereichen der Medizin und Forschung groß, doch der Einfluss von KI auf klinische Studien und die Entscheidungspunkte in dieser Phase bleibt aus mehreren Gründen begrenzt. Dieser Umstand hat Folgen für Biotech-Unternehmen, Start-ups und die gesamte Pharmaindustrie, die zunehmend auf Technologien wie maschinelles Lernen und KI setzen.
Es lohnt sich deshalb, genau zu betrachten, warum KI momentan klinische Studien nur eingeschränkt beeinflusst und welche Faktoren dafür verantwortlich sind. Die Besonderheit klinischer Studien zeigt sich bereits in der Struktur und dem finanziellen Risiko des gesamten Entwicklungszyklus eines Medikaments. Die präklinische Phase ist meist durch intensive Forschung, viele Versuchsreihen und durchaus flexibles Vorgehen geprägt. Forscher können verschiedene chemische Verbindungen testen, molekulare Mechanismen analysieren und unterschiedliche Ansätze zur Zielsetzung verfolgen. Die KI hat hier bislang vor allem bei der Vorhersage von Moleküleigenschaften, der Simulation von Wirkungsweisen und der Identifikation von Zielmolekülen ihre Stärken ausgespielt.
Der Grad der Freiheit, in dem sich die Forschungsrichtung ändern lässt, ist in diesem Stadium relativ hoch, und neue Erkenntnisse können Forschungsprojekte schnell beeinflussen. Anders gestaltet sich dies in der klinischen Phase. Sobald ein Wirkstoff diesen Bereich erreicht hat, ist der Weg streng vorgegeben: Protokolle, Dosierungen, Patientengruppen und Prüfpläne sind festgelegt, um in höchstem Maße die Vergleichbarkeit und Validität der Studienergebnisse sicherzustellen. Änderungen am Studienablauf sind mit großem Aufwand verbunden und können die Zulassung des Wirkstoffs gefährden. Genau hier entsteht ein grundlegendes Hemmnis für KI-Systeme, die oft auf Flexibilität, dynamische Anpassung und explorative Datenanalyse ausgelegt sind.
Die klinische Phase ist ein Gebiet, in dem Risiken extrem hoch sind: Milliardeninvestitionen stehen auf dem Spiel, genauso wie die Gesundheit und Sicherheit der Teilnehmer. Dieses besondere Risikoprofil führt dazu, dass Unternehmen und Entscheidungsträger in klinischen Studien sehr konservativ agieren. Sicherheit und Regulierung haben oberste Priorität, und Abläufe folgen streng festgelegten Standards, um die Zulassung bei Behörden wie der FDA oder EMA zu gewährleisten. Die Fähigkeit von KI, in einem solch restriktiven und hochregulierten Umfeld direkt wirkungsvoll zu sein, ist begrenzt. Ihre Rolle wird eher als unterstützendes Werkzeug in datenintensiven Aufgaben wahrgenommen – etwa bei der Dokumentation, Zusammenfassung von Studieninformationen oder logistischen Prozessen – als als entscheidender Faktor für die Ausgestaltung klinischer Studien selbst.
Ein weiterer wichtiger Aspekt ist die Tatsache, dass klinische Studien kaum Spielraum für die Erzeugung neuer wissenschaftlicher Erkenntnisse lassen, die auf Basis der Daten den Studienverlauf noch maßgeblich beeinflussen könnten. Das bedeutet, selbst wenn KI komplexe Muster entdeckt oder potenzielle Subgruppen mit abweichenden Reaktionen identifiziert, sind die Möglichkeiten, diese Erkenntnisse umzusetzen, stark eingeschränkt. Änderungen bedürfen umfassender Validierung, können erhebliche zeitliche Verzögerungen verursachen und das finanzielle Risiko erhöhen. Deshalb werden solche Hinweise in der Praxis oft mit Skepsis betrachtet und führen selten zu grundlegenden Kursänderungen während der klinischen Studie. Aus der Perspektive der pharmazeutischen Unternehmen ist die Einschätzung entscheidend, ob der Wirkstoff unter den vorgesehenen Bedingungen wirtschaftlich rentabel sein wird.
Die Chancen auf Erfolg, Kosten für die Durchführung der Studie sowie die potenzielle Marktgröße defineiren maßgeblich die Entscheidungen im klinischen Stadium. KI-Technologien könnten theoretisch dabei helfen, Risiken besser zu bewerten oder Subpopulationen genauer zu analysieren, doch wenn diese Ansätze zu zusätzlichen Studien, Protokolländerungen oder Verzögerungen führen, steigt der Kostendruck. Unternehmen wägen daher sehr genau ab, inwieweit KI-gestützte Analysen tatsächlich praktikabel sind. Trotz dieser Beschränkungen bedeutet das nicht, dass KI in klinischen Studien keine Rolle spielen kann oder in Zukunft nicht spielen wird. Schon heute gibt es Ansätze, die den Einsatz von KI in unterstützenden Bereichen verbessern, etwa bei der Strukturierung großer Datenmengen, der Automatisierung von Dokumentationsprozessen, der Vereinfachung regulatorischer Anforderungen oder der Patientenauswahl basierend auf vorhandenen Daten.
Diese Werkzeuge helfen, Kosten zu senken und Effizienz zu steigern, ohne den klinischen Ablauf direkt zu verändern. Außerdem sehen Experten eine mögliche kulturelle Veränderung in der Pharmaindustrie voraus. Die Bereitschaft, KI nicht nur als Assistenz, sondern als aktiven Entscheidungsträger zu akzeptieren, könnte mit zunehmender Erfahrung, besseren Modellen und mehr Vertrauen wachsen. Die hohe Komplexität von Medikamentenwirkungen im menschlichen Körper macht es schwierig, ohne individuelle und umfangreiche Expertise treffende Entscheidungen zu treffen. KI hat das Potenzial, zusätzliche Signale zu identifizieren, die menschlichen Entscheidungsträgern bisher verborgen blieben.
Gerade im Umgang mit extrem vielschichtigen biologischen Daten könnte KI zukünftig neue Impulse geben – allerdings nur, wenn die Branche gleichzeitig ihre Arbeitsweise und Risikobereitschaft anpasst. Ein anschauliches Beispiel liefert die Betrachtung eines der spektakulärsten Fehlschläge in der klinischen Entwicklung: Torcetrapib, ein Wirkstoff zur Behandlung von Herz-Kreislauf-Erkrankungen, wurde trotz beeindruckender Labor- und Frühergebnisse in der Phase 3 abgebrochen, da sich gravierende Nebenwirkungen zeigten. Rückblickend zeigt die Analyse, dass bereits frühere Studien subtil auf Risiken hinwiesen, diese aber nicht ausreichend vor dem großen, kostenintensiven Phase-3-Studienbeginn erkannt oder berücksichtigt wurden. KI-gestützte Literaturanalysen hätten hier Hinweise liefern können, doch ohne direkten Zugang zu internen Daten und ohne Änderung der klinischen Abläufe wären solche Erkenntnisse schwergewichtig gewesen. Dies veranschaulicht, wie schwierig es ist, im klinischen Stadium allein durch KI den entscheidenden Unterschied zu erzielen.
Zusammenfassend ist klar, dass KI in der Arzneimittelforschung gegenwärtig insbesondere in der präklinischen Phase ihr Potenzial entfaltet, etwa bei der Zielauswahl, der Vorhersage von Toxizitäten und der Wirkstoffoptimierung. Die klinischen Studien sind hingegen durch ihre strengen Regularien, hohe Kosten und wichtige Sicherheitsaspekte charakterisiert, die eine flexible Nutzung von KI behindern. Risiken müssen minimiert, Zeitpläne eingehalten und Investitionen optimal verteilt werden. Deshalb wird KI hier vornehmlich als Werkzeug zur Effizienzsteigerung und nicht als innovativer Entscheidungsträger eingesetzt. Für KI-Entwickler und Unternehmen im Gesundheitssektor lohnt es sich daher, die eigene Strategie auf präklinische Anwendungen und unterstützende Funktionen in klinischen Studien zu fokussieren.
Die Integration von KI in den klinischen Prozess wird vermutlich graduell erfolgen und stark von Veränderungen in regulatorischen Rahmenbedingungen, Akzeptanz in der Branche sowie der Verfügbarkeit hochwertiger Daten abhängen. In Zukunft sind aber nicht nur technologische Fortschritte entscheidend. Ebenso wichtig wird die Kultur in der pharmazeutischen Industrie sein, die Offenheit gegenüber neuen Ansätzen, die Bereitschaft, komplexe KIs als verlässliche Partner zu betrachten, und die Anpassung bestehender Abläufe, um deren Nutzen voll ausschöpfen zu können. Die nächste Generation von KI-Systemen könnte so tatsächlich eine weitaus größere Rolle spielen – doch bis dahin bleibt die wichtigste Zielgruppe für transformative KI-Anwendungen vor allem die frühe Forschung und Entwicklung, nicht die klinische Studienphase. Die Balance zwischen Innovation, Sicherheit und Wirtschaftlichkeit setzt hier klare Grenzen.
Die Diskussion um den Stellenwert von KI in klinischen Studien zeigt insgesamt, dass trotz enormer Fortschritte in der KI-Forschung das Verständnis um die Besonderheiten des pharmazeutischen Entwicklungszyklus essenziell ist. Nur mit einem ganzheitlichen Blick auf wissenschaftliche, regulatorische und wirtschaftliche Aspekte lässt sich das Potenzial künstlicher Intelligenz realistisch einschätzen und zielführend einsetzen.