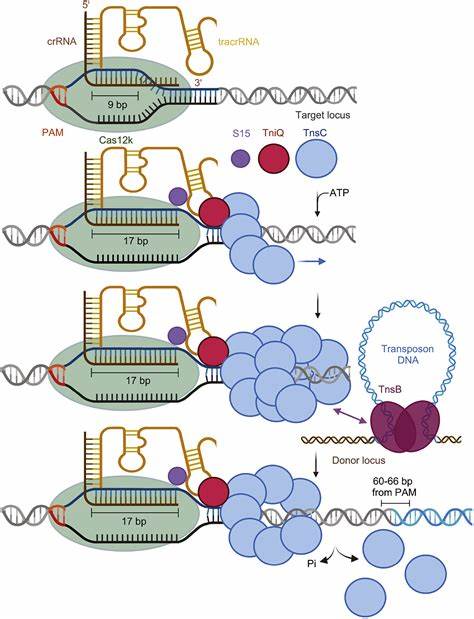
Die Integration therapeutischer DNA in das menschliche Genom hat in den letzten Jahren stark an Bedeutung gewonnen. Die Entwicklung neuer Werkzeuge, die gezielt große DNA-Segmente mit hoher Spezifität und Effizienz einfügen können, ist für Fortschritte in der Gentherapie unerlässlich. Eine vielversprechende Innovation auf diesem Gebiet ist das sogenannte Type V-K CAST System – eine kompakte, RNA-gesteuerte CRISPR-assoziierte Transposase, die gezielte Genintegration ohne die üblichen Risiken von DNA-Doppelstrangbrüchen durchführt. Diese Technologie eröffnet neue Horizonte für die Behandlung genetischer Erkrankungen und die Entwicklung sicherer Gentherapien. Typ V-K CAST beruht auf einem natürlichen Mechanismus, bei dem ein einzelnes Cas12k-Protein als Zielerkennungsmodul dient.
Im Vergleich zu anderen CAST-Systemen, wie z.B. dem Cascade-basierten Typ I-F, benötigt dieser Typ keine komplexen Proteinkomplexe – was ihn einfacher handhabbar und leichter anwendbar macht, insbesondere in humanen Zellen. Das Cas12k-Protein erkennt mittels einer programmierten RNA (sgRNA) eine spezifische DNA-Sequenz im Genom und dirigiert die Transposase-Komplexkomponenten, um das therapeutische DNA-Stück an genau definierten Stellen einzufügen. Die herausragende Eigenschaft des Type V-K CAST ist die Fähigkeit, große DNA-Segmente präzise in das Genom einzubauen, ohne dass Doppelstrangbrüche (DSB) entstehen.
Traditionelle CRISPR-Cas9-Technologien basieren auf DSBs, die den Einbau der DNA über die zellulären Reparaturmechanismen fördern, jedoch auch unerwünschte Nebeneffekte wie fehlerhafte Reparaturen, Insertionen oder Deletionen verursachen können. Type V-K CAST umgeht diese Nachteile, indem die DNA integration durch einen Transpositionsmechanismus erfolgt, der keine Brüche im Genom erzeugt. Dieser „cut-and-paste“-ähnliche Vorgang ermöglicht somit eine schonendere und kontrollierbare Genmodifikation. Metagenomische Analysen förderten eine große Vielfalt von Type V-K CAST Systemen zutage, insbesondere von bisher unkultivierten Mikroorganismen. Diese natürlichen Systeme wurden auf Aktivität hin untersucht, wobei mehrere Varianten identifiziert wurden, die in vitro effektive gezielte Integrationen mit spezifischen PAM-Sequenzen (Protospacer Adjacent Motifs) ausführen.
Durch gezieltes Engineering wurden die CAST-Komponenten für die Expression in menschlichen Zellkernen optimiert, indem ihnen Nuklear-Lokalisationssignale (NLS) angefügt wurden, welche die Zellkerntranslokation der Proteine sicherstellen. Zudem wurden durch Fusionen mit chromatin-modulierenden Domänen die Stabilität und Funktionalität der entscheidenden Cas12k- und TniQ-Proteine in der menschlichen Zellumgebung verbessert. Die Anwendung des Type V-K CAST Systems in menschlichen Zellkulturen konnte die programmierbare Integration großer DNA-Konstrukte, darunter therapeutisch relevante Gene, an sogenannten Safe-Harbor-Loci demonstrieren, insbesondere an der AAVS1-Stelle. Dieser genomische Ort gilt als sicherer Einbauplatz, da dort Integration keine kritischen Genfunktionen stört und stabile Expression ermöglicht. Die Effizienz der Integration wurde durch die Zugabe eines bakteriellen Helferproteins, ClpX, gesteigert, welches vermutlich die Transpositionskomplexe auflockert und so den Integrationsprozess erleichtert.
Die Integrationen zeigten eine bemerkenswerte Richtungstreue und hohe Spezifität mit nur seltenen Off-Target-Ereignissen, die sich in bestimmten Hotspots konzentrierten. Interessanterweise bewältigt der Type V-K CAST auch die Herausforderung, große therapeutische DNA-Abschnitte, wie z.B. den kompletten Faktor-IX-Gendefekt zur Behandlung von Hämophilie, effizient einzubauen. Die Fähigkeit, lineare DNA-Donorfragmente als Integrationsträger zu nutzen, eröffnet zudem neue Möglichkeiten hinsichtlich Herstellungs- und Lieferbarkeit der Gene – ohne die Notwendigkeit komplexer plasmidbasierter Systeme.
Spezifitätsanalysen mithilfe innovativer Sequenzierverfahren bestätigten die hohe Präzision der Integration, wobei die Detektion von vollständigen Integrationsereignissen durch parallele Freude am linken und rechten Endpunkt der Integration (LE und RE) eine zuverlässige Identifizierung erlaubte. Die Integrationsstellen außerhalb der Zielregionen beschränkten sich größtenteils auf Plasmidrückstände und wenige genomische Hotspots, die nicht durch die sgRNA-Erkennung erklärt werden konnten. Eine mögliche Reduktion dieser Effekte könnte durch Optimieren der Expression der CAST-Komponenten, insbesondere von TnsC, erzielt werden. Die universelle Anwendbarkeit des Type V-K CAST wurde zudem in unterschiedlichen Zelltypen wie HEK293T, K562 und Hep3b-Zellen gezeigt. Besonders praktisch ist, dass die Integrationsleistung in nicht replizierenden Zellen erhalten bleibt, was die therapeutische Nutzung in einer Vielzahl differenzierter Zelltypen unterstützt.
Zusammenfassend bietet das programmierbare Type V-K CAST System eine innovative Plattform für die sichere, effiziente und präzise Integration therapeutischer Genabschnitte in das menschliche Genom. Es überwindet viele Einschränkungen bisheriger Genomeditierungsverfahren, indem es das Targeting vereinfacht, Off-Target-Effekte minimiert und Integrationen ohne schädliche DNA-Doppelstrangbrüche ermöglicht. Dies legt eine vielversprechende Basis für zukünftige Gentherapien bei einer Reihe genetischer Krankheiten und eröffnet vielseitige Anwendungsperspektiven in Biotechnologie und Zelltherapie. Die kontinuierliche Optimierung, wie etwa durch die Erweiterung von Chromodomänen, feinjustierte Expression der CAST-Proteine und Verbesserungen bei der Donor-DNA-Aufbereitung, wird die Effizienz und Sicherheit dieses Systems weiter steigern. Gleichzeitig bleibt die Erforschung weiterer relevanter zellulärer Cofaktoren und deren Einbindung von großer Bedeutung, um alle Potenziale dieser Technologie ausnutzen zu können.
In Anbetracht der Wichtigkeit sicherer Genommodifikationen für klinische Anwendungen stellt Type V-K CAST einen Meilenstein dar, der den Weg für stabile, präzise und skalierbare Genintegrationen ebnet. Damit leistet dieses System einen bedeutenden Beitrag zur Beschleunigung der Entwicklung personalisierter Gentherapien und könnte zukünftig maßgeblich die Behandlungsmöglichkeiten für viele Patienten mit genetisch bedingten Erkrankungen verbessern.