Typ-2-Diabetes ist eine der am weitesten verbreiteten chronischen Erkrankungen weltweit und betrifft Millionen Menschen. Diese Stoffwechselkrankheit ist vor allem durch eine gestörte Regulierung des Blutzuckers gekennzeichnet. Doch die Auswirkungen von Typ-2-Diabetes gehen weit über die klassischen körperlichen Symptome hinaus. Neueste wissenschaftliche Erkenntnisse zeigen, dass die Krankheit auch tiefgreifende Veränderungen in den Hirnstrukturen hervorruft, die für das Verarbeiten von Belohnungen und das Verhalten verantwortlich sind. Dieser Zusammenhang wirft neue Lichtblicke auf das Verständnis von kognitiven Beeinträchtigungen bei Diabetikern und erklärt, warum es vielen Betroffenen schwerfällt, langfristige Verhaltensänderungen durchzuhalten.
Wissenschaftler der Universität von Nevada führten eine innovative Studie durch, bei der ein Tiermodell mit chronisch erhöhtem Blutzuckerspiegel untersucht wurde. Dabei wurde ein chemisches Mittel eingesetzt, um Diabetes bei Ratten zu simulieren. Die Tiere wurden daraufhin in einem speziellen Labyrinth trainiert, in dem sie eine Aufgabe mit räumlichem Gedächtnis ausführen mussten – eine sogenannte verzögerte Alternation. Dabei lernten die Tiere, zwischen links und rechts zu wechseln, um eine Belohnung in Form von zuckerfreier Schokomilch zu erhalten. Während dieser Aufgabenführung wurden die neuronalen Aktivitäten zweier wichtiger Hirnregionen gemessen: des anterioren cingulären Kortex (ACC) und des Hippocampus.
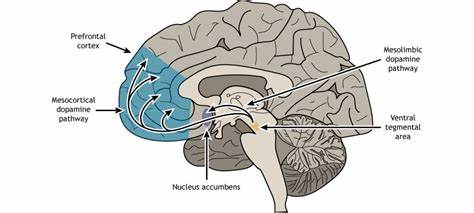
Der ACC ist ein Teil des präfrontalen Kortex und spielt eine wesentliche Rolle bei zielgerichtetem Verhalten und der Verarbeitung von Belohnungen. Der Hippocampus wiederum ist zentral für das Gedächtnis und die räumliche Orientierung. Radiotaktisch kleine Elektroden zeichneten die Feuermuster einzelner Nervenzellen auf, um zu analysieren, wie die Hirnaktivität bei den verschiedenen Abschnitten des Labyrinths variierte. Obwohl sich die Leistungen der diabetischen und der gesunden Ratten auf den ersten Blick kaum unterschieden – sie absolvierten die gleiche Anzahl an Durchläufen und erzielten vergleichbare Genauigkeit – offenbarten genauere Beobachtungen Verhaltensunterschiede. Die Ratten mit Diabetes verweilten weniger lange am Ort der Belohnung als die gesunden Tiere.
Während diese oft nach der Belohnung innehielten, zeigte sich bei den diabetischen Tieren eine raschere Weiterbewegung, was auf eine verminderte Sensibilität gegenüber der Belohnung hinweist. Auf neuronaler Ebene unterlagen die Aktivitäten im anterioren cingulären Kortex wesentlichen Modifikationen. Zwar waren die allgemeinen Feuerraten der Nervenzellen in beiden Gruppen ähnlich, doch bei den diabetischen Ratten war die räumliche Informationskodierung ausgeprägter. Viele Neuronen agierten als sogenannte Platz-Zellen, die nur an bestimmten Orten im Labyrinth aktiv werden. Auffällig war, dass diese Platz-Zellen bei den Diabetikern nicht gleichmäßig im Labyrinth verteilt waren.
Sie konzentrierten sich vor allem in den Bereichen direkt vor der Belohnungszone, woraus abzuleiten ist, dass die Belohnung eher antizipiert als tatsächlich wahrgenommen wurde. Gesunde Tiere zeigten dagegen eine balancierte Verteilung der neuronalen Aktivitäten mit einem Schwerpunkt auf die unmittelbare Belohnungsstelle, was sowohl Erwartung als auch Erhalt der Belohnung widerspiegelt. Diese Erkenntnisse haben weitreichende Implikationen. Sie zeigen, dass Typ-2-Diabetes nicht nur die metabolischen Prozesse im Körper beeinträchtigt, sondern auch die neuronale Verarbeitung von Belohnungen verändert. Dies könnte erklären, warum es vielen Diabetespatienten so schwerfällt, sich an Lebensstiländerungen wie gesunde Ernährung oder regelmäßige Bewegung zu halten.
Die übliche Antwort des Gehirns auf positive Verstärkungen ist bei ihnen abgeschwächt, wodurch die Motivation sinken kann. Darüber hinaus werfen die Ergebnisse Licht auf den Zusammenhang zwischen Diabetes und neurodegenerativen Erkrankungen wie Alzheimer. Diabetes gilt als der wichtigste modifizierbare Risikofaktor für die Alzheimer-Krankheit. Bereits in frühen Stadien der kognitiven Verschlechterung, noch bevor klare diagnostische Kriterien erfüllt sind, kommt es offenbar zu Veränderungen in Hirnschaltkreisen ähnlich denen, die bei Diabetes beobachtet werden. Das könnte darauf hindeuten, dass Diabetes die neuronale Flexibilität verringert und Compensationsmechanismen initiiert, die die Symptome zunächst verschleiern, aber später zu einem raschen Verfall führen können.
Die Verbindung zwischen Belohnungsverarbeitung und Gedächtnisfunktionen wird zusätzlich durch die synchronisierte Aktivität von Neuronen mit sogenannten Theta-Oszillationen bekräftigt. Diese rhythmischen Hirnwellen sind bekannt für ihre Rolle bei Gedächtnisprozessen und der Orientierung. In den Kontrolltieren waren Neuronen, die synchron zur Theta-Rhythmik feuerten, besonders wichtig für die Kodierung belohnungsrelevanter Informationen. Bei den diabetischen Ratten war diese Kodierung zwar strukturell erhalten, aber inhaltlich stark reduziert. Das deutet darauf hin, dass die Kommunikation zwischen Gehirnregionen zwar funktioniert, jedoch die übermittelten Informationen verändert sind.
Aus Sicht der Neurowissenschaften eröffnet diese Studie vielversprechende neue Wege für das Verständnis, wie chronisch metabolische Erkrankungen das Gehirn beeinflussen. Wichtige Fragen sind, inwieweit sich diese Veränderungen reversibel gestalten lassen und ob präventive Behandlungsansätze, vorhandene Medikamente oder gezielte Lebensstilmaßnahmen negative Veränderungen im Hirn verhindern oder rückgängig machen können. Ein möglicher zugrundeliegender Mechanismus könnte in der Schädigung von Glukose-sensitiven Neuronen im anterioren cingulären Kortex liegen, die durch chronisch erhöhten Blutzucker geschädigt werden. Weiterhin spielen veränderte Konzentrationen von Hirnmetaboliten wie Myo-Inositol eine Rolle. Myo-Inositol ist bei Diabetikern häufig erhöht und wird mit einer schlechteren Hirnkonnektivität und kognitivem Verfall in Verbindung gebracht.
Während die aktuelle Forschung vor allem auf Tiermodellen basiert und somit noch Vorsicht bei der Übertragung auf den Menschen geboten ist, sind die Erkenntnisse dennoch wegweisend. Sie unterstreichen die Bedeutung einer frühzeitigen Blutzucker-Kontrolle und regelmäßigen medizinischen Überwachung, um das Fortschreiten von Diabetes und dessen Folgeschäden zu minimieren. Eine stabile Blutzuckerregulation könnte helfen, die Gehirnfunktionen zu schützen und kognitive Einbußen langfristig zu reduzieren. Zusammenfassend lässt sich sagen, dass Typ-2-Diabetes weitreichende Auswirkungen auf das Gehirn hat, die über die bekannten körperlichen Symptome hinausgehen. Die veränderte Verarbeitung von Belohnungen wirkt sich auf Motivation und Verhalten aus und stellt somit einen wichtigen Faktor für den Therapieerfolg und die Lebensqualität der Betroffenen dar.
Die Verknüpfung zwischen den Symptomen von Typ-2-Diabetes und den frühen Stadien neurodegenerativer Erkrankungen eröffnet neue Perspektiven für die Früherkennung und Prävention von Demenzen. Zukünftige Forschungen müssen untersuchen, wie sich die kognitiven und neuronalen Veränderungen durch gezielte Interventionen positiv beeinflussen lassen, um die geistige Gesundheit bei Diabetespatienten langfristig zu erhalten.